题目内容
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、溴水溶液Na+ K+ NO3- CH3CHO |
| B、氢氧化钠溶液AlO2- K+ Cl- NO3- |
| C、氢氧化铁胶体H+ K+ S2- Cl- |
| D、高锰酸钾溶液H+ Na+ SO42- CH3CH2OH |
考点:离子共存问题
专题:离子反应专题
分析:A.溴水具有强氧化性,具有还原性的物质不能共存;
B.离子之间不发生任何反应;
C.H+与S2-反应生成气体,且胶体发生聚沉;
D.高锰酸钾具有强氧化性,乙醇被氧化.
B.离子之间不发生任何反应;
C.H+与S2-反应生成气体,且胶体发生聚沉;
D.高锰酸钾具有强氧化性,乙醇被氧化.
解答:
解:A.溴水具有强氧化性,具有还原性CH3CHO不能共存,故A错误;
B.碱性条件下,离子之间不发生任何反应,可大量共存,故B正确;
C.H+与S2-反应生成气体,且胶体在酸性发生聚沉,故C错误;
D.高锰酸钾具有强氧化性,乙醇被氧化而不能大量共存,故D错误.
故选B.
B.碱性条件下,离子之间不发生任何反应,可大量共存,故B正确;
C.H+与S2-反应生成气体,且胶体在酸性发生聚沉,故C错误;
D.高锰酸钾具有强氧化性,乙醇被氧化而不能大量共存,故D错误.
故选B.
点评:本题综合考查元素化合物知识,题目贴近高考,难度适中,侧重于学生的分析能力和元素化合物知识综合理解和运用的考查,着力于双基的考查,有利于培养学生良好的科学素养.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
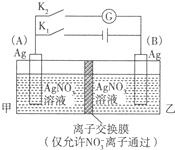 利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )
利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )| A、闭合K1,断开K2后,A电极增重 |
| B、闭合K1,断开K2后,乙池溶液浓度上升 |
| C、断开K1,闭合K2后,NO3-向B电极移动 |
| D、断开K1,闭合K2后,A电极发生氧化反应 |
硼的原子序数为5,硼的最高价含氧酸的化学式不可能是( )
| A、HBO2 |
| B、H3BO3 |
| C、H2BO3 |
| D、H4B2O5 |
对100mL 1mol?L-1的Na2CO3溶液,下列说法不正确的是( )
A、将溶液稀释,
| ||
| B、滴入含0.1 mol CH3COOH的溶液:c(CH3COO-)<c(HCO3-) | ||
| C、通入0.1 mol CO2气体,溶液中存在:c(Na+)=c(CO32-)十c(HCO3-)+c(H2CO3) | ||
| D、滴入酚酞,微热,溶液颜色加深 |
一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g)△H<0,反应经60s达到平衡并生成0.3mol Z,则下列说法中正确的是( )
| A、以Y浓度变化表示的反应速率为0.0005mol/(L?s) | ||
B、其他条件不变,将容器体积扩大至20L,则Z的平衡浓度变为原来的
| ||
| C、其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 | ||
| D、其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.该法的工艺流程为:CrO42-
Cr2O72-
Cr3+
Cr(OH)3↓,其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,下列说法错误的是( )
| H+ | ||
|
| Fe2+ | ||
|
| OH- | ||
|
| A、在第①反应平衡体系中加入水,溶液中c(H+)增大 |
| B、溶液的pH值不变时,说明第①步反应达平衡状态 |
| C、第②步中,还原0.01mol Cr2O72-离子,需要0.06mol的FeSO4?7H2O |
| D、上述三步转化反应中,只有一个反应为氧化还原反应 |
空气、水、土壤及食品的污染,一定程度影响了人类生活,下列有关说法错误的是( )
| A、雾霾天气中的主要污染物是PM2.5,其中含氮的有机物和光发生化学作用,可形成光化学烟雾 |
| B、砷是水污染的重要因素之一,其最高价含氧酸砷酸的酸性比磷酸酸性弱 |
| C、土壤污染物可分为无机污染物和有机污染物,农药污染多为有机污染物 |
D、苏丹红是人工合成的一种工业染料,若掺入饲料中饲养禽类会污染蛋类食品,它的结构简式是 ,其分子式是:C22H18N4O ,其分子式是:C22H18N4O |
 生产生活中广泛涉及氧化还原反应.
生产生活中广泛涉及氧化还原反应.