题目内容
能正确表示下列化学反应的离子方程式的是( )
| A、氢氧化钡溶液与稀硫酸的反应 OH-+H+=H2O |
| B、氧化钙与稀盐酸反应CaO+2H+=Ca2++H2O |
| C、铁片插入硝酸银溶液中Fe+Ag+=Fe2++Ag |
| D、碳酸钙溶于稀硝酸中 CO32++2H+=CO2↑+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.漏掉钡离子与硫酸根离子的反应;
B.氧化钙与盐酸反应生成氯化钙和水;
C.电荷不守恒;
D.碳酸钙为沉淀,应保留化学式.
B.氧化钙与盐酸反应生成氯化钙和水;
C.电荷不守恒;
D.碳酸钙为沉淀,应保留化学式.
解答:
解:A.氢氧化钡溶液与稀硫酸的反应,离子方程式为:Ba2++SO42-+2OH-+H+=2H2O+BaSO4↓,故A错误;
B.氧化钙与稀盐酸反应,离子方程式:CaO+2H+=Ca2++H2O,故B正确;
C.铁片插入硝酸银溶液中,离子方程式为:Fe+2Ag+=Fe2++2Ag,故C错误;
D.碳酸钙溶于稀硝酸中,离子方程式为:CaCO3+2H+=CO2↑+H2O+Ca2+,故D错误;
故选:B.
B.氧化钙与稀盐酸反应,离子方程式:CaO+2H+=Ca2++H2O,故B正确;
C.铁片插入硝酸银溶液中,离子方程式为:Fe+2Ag+=Fe2++2Ag,故C错误;
D.碳酸钙溶于稀硝酸中,离子方程式为:CaCO3+2H+=CO2↑+H2O+Ca2+,故D错误;
故选:B.
点评:本题考查了离子方程式的书写,题目难度不大,明确反应的实质是解题关键,注意离子方程式应遵循客观事实、遵循电荷、原子个数守恒规律.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
化学与生活密切相关,下列说法错误的是( )
| A、含有重金属的电器废品不能随意丢弃,要分类回收并利用 |
| B、食品中都必须添加大量的化学防腐剂,使食品保质期更长久, |
| C、采用加热消毒的目的是使蛋白质变性而杀灭细菌消毒 |
| D、使用乙醇作为汽油的代用品,可以减少汽车尾气中有害气体排放 |
在酸性溶液中能大量共存而且为无色透明的溶液是( )
| A、K+、Al3+、SO42-、NO3- |
| B、K+、Na+、NO3-、AlO2- |
| C、K+、Na+、Fe3+、NO3- |
| D、Na+、K+、HCO3-、NO3- |
在碱性溶液中,能大量共存的离子组是( )
| A、K+、HCO3-、Na+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、Ba2+、NO3-、Cl-、K+ |
| D、Ca2+、K+、CO32-、NO3- |
下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A、常温常压下28克N2所含的原子数目为2NA |
| B、标准状况下0.5molH2O含有的原子数目为1.5NA |
| C、任何条件下0.5mol氨气分子的分子数一定是0.5NA |
| D、49克H2SO4中含有的原子数目为1.5NA |
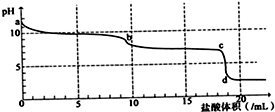 常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如图,则下列说法正确的是( )
常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如图,则下列说法正确的是( )| A、a点时溶液pH=11.5,原因是:CO32-+H2O→HCO3-+OH- |
| B、a-b段发生反应为:CO32-+2H+→CO2↑+H2O |
| C、b-c段发生反应为:HCO3-+H+→CO2↑+H2O |
| D、c-d段发生反应为:H++OH-→H2O |
碳酸钠俗名纯碱,下面是对纯碱采用不同分类法的分类,其中正确的是( )
(1)碱 (2)含氧酸盐 (3)钠盐 (4)碳酸盐.
(1)碱 (2)含氧酸盐 (3)钠盐 (4)碳酸盐.
| A、(1)(2)(3) |
| B、(1)(3)(4) |
| C、(1)(2)(4) |
| D、(2)(3)(4) |
下列叙述正确的是( )
| A、硫酸铵溶液中加入适量氨水,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B、常温下,等物质的量浓度的 (NH4)2CO3 和Na2CO3溶液,前者的c(HCO3-)小 |
| C、NaHCO3溶液中离子浓度有如下关系:c(CO32-)+c (OH-)=c (H+)+c(H2CO3) |
| D、等物质的量浓度、等体积的NaX和弱酸HX溶液混合后,各粒子浓度关系是:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
 ,生产过程如图:
,生产过程如图:
 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是