题目内容
9.下列说法正确的是( )| A. | 原子最外层电子数大于4的元素可能是金属元素 | |
| B. | 含有共价键的物质一定是共价化合物 | |
| C. | 离子化合物中只可能含有离子键而不可能含有共价键 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
分析 A.非金属元素的最外层电子数一般大于4,但某些金属元素的最外层电子数大于4;
B.只含共价键的化合物为共价化合物;
C.离子化合物中一定含有离子键,可能含有共价键;
D.多种非金属元素原子分子中的共价键,可能为极性键,也可为非极性键.
解答 解:A.非金属元素的最外层电子数一般大于4,在反应中易得到电子,则原子最外层电子数大于4的元素一定是非金属元素,但某些金属元素的最外层电子数大于4,如锑和铋等,故A正确;
B.含离子键的化合物一定为离子化合物,则只含共价键的化合物为共价化合物,故B错误;
C.含离子键的化合物一定为离子化合物,可能含共价键,故C错误;
D.多种非金属元素原子分子中的共价键,可能为极性键,也可为非极性键,如H2O2中H-O为极性键,O-O为非极性键,故D错误;
故选A.
点评 本题考查共价键及共价键的形成,为高频考点,把握化学键的形成及化合物的分类为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
20.已知2A2(g)+B2(g)?2C3(g)△H=-a kJ/mol(a>0),在一个有催化剂、固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达到平衡后C3的浓度为x mol•L-1,放出热量b KJ.请回答下列问题.
(1)a>(填“>”、“=”或“<”)b.
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<(填“>”、“<”或“=”)T2.
若在原来的容器中,只加入2mol C3,500℃时充分反应达到平衡后,吸收热量c KJ,则C3的浓度=(填“>”、“=”或“<”)x mol•L-1,a、b、c之间满足何种关系?a=b+c(用代数式表示).
(3)在相同条件下要得到2a KJ热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2和2mol C3
C.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量d kJ,则d>(填“>”、“=”或“<”)b,理由是由于恒压容器中压强比恒容容器中的大,故反应物的转化率较高,生成C3比恒容时多,则放出的热量也多.
(6)在一定温度下,向一个容积不变的容器中通入2mol A2和1mol B2及适量固体催化剂,使反应达到平衡.保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,则平衡时A2的转化率变大(填“不变”、“变大”“变小”或“不能确定”).
(1)a>(填“>”、“=”或“<”)b.
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<(填“>”、“<”或“=”)T2.
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
(3)在相同条件下要得到2a KJ热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2和2mol C3
C.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量d kJ,则d>(填“>”、“=”或“<”)b,理由是由于恒压容器中压强比恒容容器中的大,故反应物的转化率较高,生成C3比恒容时多,则放出的热量也多.
(6)在一定温度下,向一个容积不变的容器中通入2mol A2和1mol B2及适量固体催化剂,使反应达到平衡.保持同一反应温度,在相同容器中,将起始物质改为4mol A2、2mol B2,则平衡时A2的转化率变大(填“不变”、“变大”“变小”或“不能确定”).
14.价电子构型为3d54s2的元素属于( )
| A. | 稀有气体 | B. | 过渡元素 | C. | 氧族元素 | D. | 卤族元素 |
18. 如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
 如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
如图为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )| A. | 常压下,五种元素的单质中,Z单质的沸点最高 | |
| B. | W的氢化物比X的氢化物的稳定性高 | |
| C. | Y元素比W元素的非金属性强 | |
| D. | Y、Z的简单阴离子的电子层结构都与B原子的相同 |
19.下列叙述错误的是( )
| A. | Si可用于制造太阳能电池 | |
| B. | Na2O2可用于呼吸面具中作为氧气的来源 | |
| C. | Fe2O3常用于制造红色油漆和涂料 | |
| D. | 常温下可用铝制容器盛装稀硫酸 |
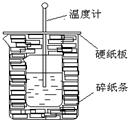 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: