题目内容
11.300gFeO、Al2O3、MgO、SiO2的混合物中,加入足量的稀硝酸,收集到气体22.4L(标况)且得到3g沉淀.将等质量的此混合物加入足量的NaOH中得到沉淀246g.则此混合物中MgO的质量分数为( )| A. | 10% | B. | 34% | C. | 72% | D. | 17% |
分析 只有FeO与稀硝酸反应生成NO气体,根据电子守恒计算出FeO的物质的量,然后根据n=nM计算出氧化亚铁的质量;FeO、Al2O3、MgO都溶于稀硝酸,剩余的3g沉淀为SiO2;将等质量的此混合物加入足量的NaOH中,Al2O3、SiO2参加反应,得到的246g沉淀为FeO、MgO的质量,根据氧化亚铁的质量可计算出MgO的质量,最后计算出混合物中MgO的质量分数.
解答 解:标准状况下22.4L气体的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,只有FeO与稀硝酸反应生成NO气体,根据电子守恒混合物中FeO的物质的量为:$\frac{1mol×(5-2)}{3-2}$=3mol,则混合物中FeO的质量为:72g/mol×3mol=216g;FeO、Al2O3、MgO都溶于稀硝酸,则剩余的3g沉淀为混合物中SiO2的质量;
将等质量的此混合物加入足量的NaOH中,只有Al2O3、SiO2参加反应,得到的246g沉淀为FeO、MgO的质量,则混合物中MgO的质量为:246g-216g-=30g,
所以混合物中MgO的质量分数为:$\frac{30g}{300g}$×100%=10%,
故选A.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
1.要将BaCl2、NaCl的混合溶液中分别得到纯净的BaCl2和NaCl晶体,在一系列的操作中应选用的试剂是( )
| A. | K2CO3稀盐酸 | B. | Na2CO3 稀盐酸 | C. | Na2CO3稀硫酸 | D. | NaOH 稀盐酸 |
2.图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )
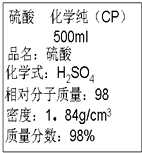

| A. | 该硫酸的物质的量浓度为9.2 mol•L-1 | |
| B. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸25 mL | |
| C. | 该硫酸与等体积的水混合后所得溶液浓度为9.2 mol•L-1 | |
| D. | 该硫酸与等体积水混合后质量分数大于49% |
19.下列有关实验装置进行的相应实验,能达到实验目的是( )
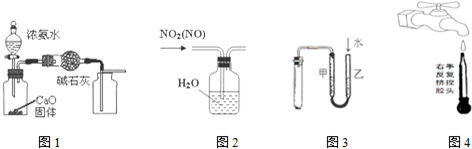

| A. | 用图1装置制取并收集干燥纯净的NH3 | |
| B. | 用图2所示装置可除去NO2中的NO | |
| C. | 用图3所示装置检验装置的气密性 | |
| D. | 图④是实验室洗涤胶头滴管的操作 |
16.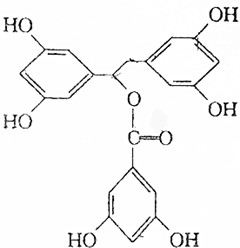 某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
 某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )| A. | 7:9:9 | B. | 8:9:9 | C. | 7:10:9 | D. | 7:9:6 |
4. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.
(1)催化剂能加快化学反应速率的原因是降低了反应的活化能.
(2)实验①和②的目的是探究浓度对反应速率的影响.
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示.分析图示能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.| 编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5% 5H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
(2)实验①和②的目的是探究浓度对反应速率的影响.
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示.分析图示能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
1.下列既能和酸性氧化物反应又能跟碱性氧化物反应,它本身也属于氧化物的是( )
| A. | CO2 | B. | Ca(OH)2 | C. | H2O | D. | CaO |
2.下列电离方程式中,书写正确的是( )
| A. | Ba(OH)2?Ba2++2 OH- | B. | H3PO4?3 H++PO43- | ||
| C. | NaHCO3═Na++H++CO3 2- | D. | HClO?H++ClO- |