题目内容
2.下列电离方程式中,书写正确的是( )| A. | Ba(OH)2?Ba2++2 OH- | B. | H3PO4?3 H++PO43- | ||
| C. | NaHCO3═Na++H++CO3 2- | D. | HClO?H++ClO- |
分析 A.氢氧化钡为强电解质,电离方程式不能用可逆号;
B.磷酸为弱酸,电离过程分步进行,电离方程式主要写出第一步即可;
C.碳酸氢钠电离出的碳酸氢根离子不能拆开;
D.次氯酸为弱酸,部分电离出氢离子和次氯酸根离子,存在电离平衡.
解答 解:A.氢氧化钡为强电解质,在溶液中完全电离,正确的电离方程式为:Ba(OH)2=Ba2++2OH-,故A错误;
B.磷酸为弱电解质,在溶液中部分电离,电离方程式主要以第一步为主,正确的电离方程式为:H3PO4?H++HPO42-,故B错误;
C.碳酸氢钠电离出钠离子和碳酸氢根离子,碳酸氢根离子不能拆开,正确的电离方程式为:NaHCO3═Na++HCO3-,故C错误;
D.次氯酸为弱酸,在溶液中部分电离出氢离子和次氯酸根离子,电离方程式为:HClO?H++ClO-,故D正确;
故选D.
点评 本题考查了电离方程式的判断,为高考的高频题,属于中等难度的试题,明确电离方程式的书写原则为解答关键,注意多元弱酸的电离方程式写出第一步电离即可,试题培养了学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.300gFeO、Al2O3、MgO、SiO2的混合物中,加入足量的稀硝酸,收集到气体22.4L(标况)且得到3g沉淀.将等质量的此混合物加入足量的NaOH中得到沉淀246g.则此混合物中MgO的质量分数为( )
| A. | 10% | B. | 34% | C. | 72% | D. | 17% |
10.锗(Ge)是第四周期第ⅣA族元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是( )
| A. | 锗是一种金属性很强的元素 | B. | 锗的单质具有半导体的性能 | ||
| C. | 锗化氢(GeH4)稳定性很强 | D. | 锗酸(H4GeO4)是难溶于水的弱酸 |
7.碳酸二甲酯(简称DMC)是一种新化工原料,2008年在欧洲被誉为“非毒性化学品”.下列关于DMC的说法中正确的是( )
| A. | DMC的结构简式为 | |
| B. | DMC在空气不能燃烧 | |
| C. | DMC易溶于水,不溶于乙醇和丙酮 | |
| D. | DMC用于生产非毒性化工产品,故被誉为有机合成的“绿色化工原料” |
14.下列有关有机物分离提纯或除杂的方法正确的是( )
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出I2 | |
| B. | 除去乙醇中的微量水可加入金属钠,使其完全反应 | |
| C. | 乙酸乙酯中有乙酸杂质,可以加入氢氧化钠溶液,充分反应后静置分液 | |
| D. | 乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶,再干燥 |
11.如果将氧化还原反应:4NH3+3O2═2N2+6H2O设计成原电池,则其正极或负极的电极反应式不可能是( )
| A. | O2+4H++4e-=2H2O | B. | O2+2H2O+4e-=4OH- | ||
| C. | N2H4+4OH--4e-=N2+4H2O | D. | N2H4+4H++2e-=2NH4+ |
11.通过化学反应不能实现的是( )
| A. | 生成一种新离子 | B. | 生成一种新分子 | C. | 生成一种新核素 | D. | 生成一种新单质 |
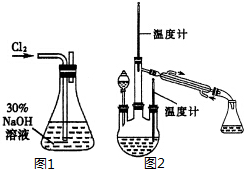 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).