题目内容
下列说法正确的是( )
| A、向Al2(SO4)3溶液中加过量的NaOH溶液可制备Al(OH)3 |
| B、将过量的过氧化钠投入FeCl2溶液中,最终看到白色沉淀 |
| C、用稀硫酸清洗做焰色反应的铁丝 |
| D、镁合金的硬度和强度均高于纯镁 |
考点:镁、铝的重要化合物,钠的重要化合物,焰色反应
专题:几种重要的金属及其化合物
分析:A、Al(OH)3是两性氢氧化物,可以与强酸强碱反应而溶解;
B、过氧化钠具有强氧化性,可与水反应生成氢氧化钠和氧气,氧气和Na2O2具有强氧化性,可以把Fe2+氧化为Fe3+,以此解答;
C、焰色反应操作中,用盐酸清洗铂丝或铁丝;
D、合金熔点比其成分金属低,硬度、强度比其成分金属大;
B、过氧化钠具有强氧化性,可与水反应生成氢氧化钠和氧气,氧气和Na2O2具有强氧化性,可以把Fe2+氧化为Fe3+,以此解答;
C、焰色反应操作中,用盐酸清洗铂丝或铁丝;
D、合金熔点比其成分金属低,硬度、强度比其成分金属大;
解答:
解:A、由于Al(OH)3是两性氢氧化物,可以与强酸强碱反应而溶解,所以向Al2(SO4)3溶液中加过量的NaOH溶液,生成的氢氧化铝又会溶解在过量的氢氧化钠溶液里生成偏铝酸钠,故A错误;
B、Na2O2投入FeCl2溶液中,发生的反应为:2Na2O2+2H2O=4NaOH+O2↑,氧气和Na2O2具有强氧化性,可以把Fe2+氧化为Fe3+,Fe3+与氢氧化钠反应,3OH-+Fe3+=Fe(OH)3↓,立即生成红褐色的Fe(OH)3沉淀,所以最终有红褐色沉淀生成,故B错误;
C、做焰色实验的铂丝在每次实验后应用盐酸洗干净,不用硫酸,因为硫酸盐难挥发,故C错误;
D、一般来说合金熔点比其成分金属低,硬度、强度比其成分金属大,镁合金的硬度和强度均高于纯镁,故D正确;
故选:D;
B、Na2O2投入FeCl2溶液中,发生的反应为:2Na2O2+2H2O=4NaOH+O2↑,氧气和Na2O2具有强氧化性,可以把Fe2+氧化为Fe3+,Fe3+与氢氧化钠反应,3OH-+Fe3+=Fe(OH)3↓,立即生成红褐色的Fe(OH)3沉淀,所以最终有红褐色沉淀生成,故B错误;
C、做焰色实验的铂丝在每次实验后应用盐酸洗干净,不用硫酸,因为硫酸盐难挥发,故C错误;
D、一般来说合金熔点比其成分金属低,硬度、强度比其成分金属大,镁合金的硬度和强度均高于纯镁,故D正确;
故选:D;
点评:主要考查了钠、铝、铁的一些性质以及焰色反应的实验,关键要求熟练掌握元素化合物的性质及应用,平时要注意积累.

练习册系列答案
相关题目
在1LNa2SO4的Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,加入1L0.3mol/L的BaCl2溶液恰好使SO42-完全沉淀,则混合容易中Na+的浓度为( )
| A、0.3mol/L |
| B、0.45mol/L |
| C、0.6mol/L |
| D、0.15mol/L |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温常压下,14 g CO中含有的原子数目为NA |
| B、标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA |
| C、25℃时,pH=13的1.0 L的Ba(OH)2溶液中含有的OH-数目为0.2 NA |
| D、1L1mol?L-1的NaClO 溶液中含有ClO-的数目为NA |
下列电离方程式正确的是( )
| A、NaHCO3═Na++H++CO32- |
| B、NaHSO4═Na++H++SO42- |
| C、H2SO4═2H++SO4- |
| D、KClO3═K++Cl-+3O2- |
下列关于Al(OH)3的性质叙述中错误的是( )
| A、Al(OH)3与过量的浓氨水反应生成NH4AlO2 |
| B、Al(OH)3是难溶于水的白色胶状物质 |
| C、Al(OH)3胶体能凝聚水中的悬浮物 |
| D、Al(OH)3受热能分解 |
下列各组反应中最终肯定不生成白色沉淀的是( )
| A、AlCl3溶液中加入过量的氨水 |
| B、MgCl2溶液中加入过量的氨水 |
| C、Al2(SO4)3溶液中加入过量的KOH溶液 |
| D、MgSO4溶液中加入过量的KOH溶液 |
下列各组离子能大量共存的是( )
| A、I-、ClO-、H+、Na+ |
| B、K+、HCO3-、OH-、NH4+ |
| C、Fe3+、Cu2+、SO42-、Cl- |
| D、Ca2+、Na+、SO42-、SO32- |
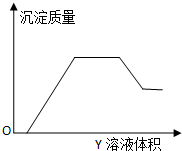 向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,表中符合图象的一组是( )
向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,表中符合图象的一组是( )