题目内容
铝土矿是工业上制取铝的基本原料.为了除去铝土矿中少量的铁红、石英等杂质制得纯净的氧化铝某化学兴趣小组设计探究实验,操作过程如图所示:
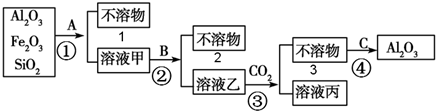
(1)A、B、C是试剂或方法,A是 (写名称);不溶物1与试剂B反应的离子方程式 ; C是
(2)为了加快流程①中的酸溶过程,可以采取的措施是 (请写出一条)
(3)流程①②③都涉及到“过滤”操作,实验室中过滤需要使用的玻璃仪器有烧杯、 .
(4)写出流程③的离子反应方程式(其中通入的二氧化碳是过量的)
(5)如果试剂A、B互换,则流程③中通入CO2应换成的试剂的化学式为 .

(1)A、B、C是试剂或方法,A是
(2)为了加快流程①中的酸溶过程,可以采取的措施是
(3)流程①②③都涉及到“过滤”操作,实验室中过滤需要使用的玻璃仪器有烧杯、
(4)写出流程③的离子反应方程式(其中通入的二氧化碳是过量的)
(5)如果试剂A、B互换,则流程③中通入CO2应换成的试剂的化学式为
考点:镁、铝的重要化合物,硅和二氧化硅,铁的氧化物和氢氧化物,制备实验方案的设计
专题:几种重要的金属及其化合物
分析:氧化铝是两性氧化物,既溶液强酸又溶于强碱.Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸.
由工艺流程可知,溶液乙中通入二氧化碳得到不溶物,不溶物可以得到氧化铝,故溶液乙中含有偏铝酸根,则A应为盐酸,过滤得到不溶为SiO2,溶液甲中含有铝离子、铁离子,再加入氢氧化钠溶液,除去铁离子,不溶物为氢氧化铁,将铝离子转化为偏铝酸根,过滤偏铝酸根进入溶液乙中,在溶液中与二氧化碳反应生成Al(OH)3,加热生成Al2O3;
若将A、B互换,溶液甲中含有偏铝酸根离子、硅酸根离子,再加入盐酸,溶液乙中主要含有铝离子、氯离子、钠离子,应加入氨水将铝离子转化氢氧化铝沉淀.加热溶液乙,HCl挥发、铝离子水解,得到Al(OH)3及NaCl,灼烧Al(OH)3分解生成Al2O3,据此解答.
由工艺流程可知,溶液乙中通入二氧化碳得到不溶物,不溶物可以得到氧化铝,故溶液乙中含有偏铝酸根,则A应为盐酸,过滤得到不溶为SiO2,溶液甲中含有铝离子、铁离子,再加入氢氧化钠溶液,除去铁离子,不溶物为氢氧化铁,将铝离子转化为偏铝酸根,过滤偏铝酸根进入溶液乙中,在溶液中与二氧化碳反应生成Al(OH)3,加热生成Al2O3;
若将A、B互换,溶液甲中含有偏铝酸根离子、硅酸根离子,再加入盐酸,溶液乙中主要含有铝离子、氯离子、钠离子,应加入氨水将铝离子转化氢氧化铝沉淀.加热溶液乙,HCl挥发、铝离子水解,得到Al(OH)3及NaCl,灼烧Al(OH)3分解生成Al2O3,据此解答.
解答:
解:氧化铝是两性氧化物,既溶液强酸又溶于强碱.Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸.
由工艺流程可知,溶液乙中通入二氧化碳得到不溶物,不溶物可以得到氧化铝,故溶液乙中含有偏铝酸根,则A应为盐酸,过滤得到不溶为SiO2,溶液甲中含有铝离子、铁离子,再加入氢氧化钠溶液,除去铁离子,不溶物为氢氧化铁,将铝离子转化为偏铝酸根,过滤偏铝酸根进入溶液乙中,在溶液中与二氧化碳反应生成Al(OH)3,加热生成Al2O3,
(1)由上述分析可知,A为盐酸,不溶物1为SiO2,B为氢氧化钠溶液,故反应的离子方程式为SiO2+2OH-=SiO32-+H2O,不溶物3为氢氧化铝通过操作C生成氧化铝故C是灼烧,故答案为:盐酸;SiO2+2OH-=SiO32-+H2O;灼烧;
(2)为了加快流程①中的酸溶过程,实质是加快反应速率,故可以将铝土矿碎成粉末;增大酸的浓度等;故答案:将铝土矿碎成粉末;增大酸的浓度等;
(3)过滤用到的玻璃仪器有漏斗、烧杯、玻璃棒,故答案:玻璃棒、漏斗;
(4)流程③是偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(5)若将A、B互换,溶液甲中含有偏铝酸根离子、硅酸根离子,再加入盐酸,溶液乙中主要含有铝离子、氯离子、钠离子,应加入氨水将铝离子转化氢氧化铝沉淀,
故答案为:氨水;
由工艺流程可知,溶液乙中通入二氧化碳得到不溶物,不溶物可以得到氧化铝,故溶液乙中含有偏铝酸根,则A应为盐酸,过滤得到不溶为SiO2,溶液甲中含有铝离子、铁离子,再加入氢氧化钠溶液,除去铁离子,不溶物为氢氧化铁,将铝离子转化为偏铝酸根,过滤偏铝酸根进入溶液乙中,在溶液中与二氧化碳反应生成Al(OH)3,加热生成Al2O3,
(1)由上述分析可知,A为盐酸,不溶物1为SiO2,B为氢氧化钠溶液,故反应的离子方程式为SiO2+2OH-=SiO32-+H2O,不溶物3为氢氧化铝通过操作C生成氧化铝故C是灼烧,故答案为:盐酸;SiO2+2OH-=SiO32-+H2O;灼烧;
(2)为了加快流程①中的酸溶过程,实质是加快反应速率,故可以将铝土矿碎成粉末;增大酸的浓度等;故答案:将铝土矿碎成粉末;增大酸的浓度等;
(3)过滤用到的玻璃仪器有漏斗、烧杯、玻璃棒,故答案:玻璃棒、漏斗;
(4)流程③是偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(5)若将A、B互换,溶液甲中含有偏铝酸根离子、硅酸根离子,再加入盐酸,溶液乙中主要含有铝离子、氯离子、钠离子,应加入氨水将铝离子转化氢氧化铝沉淀,
故答案为:氨水;
点评:本题以框图题形式考查铝的化合物的性质、对工艺流程的理解等,难度中等,理解工艺流程是解题关键,是对知识迁移的综合运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L水中含有的水分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、32 g O2分子和32 g O3分子所含的氧原子数目相等 |
下列物质中属于纯净物的是( )
| A、液氨 | B、漂白粉 | C、氯水 | D、盐酸 |
下列说法正确的是( )
| A、向Al2(SO4)3溶液中加过量的NaOH溶液可制备Al(OH)3 |
| B、将过量的过氧化钠投入FeCl2溶液中,最终看到白色沉淀 |
| C、用稀硫酸清洗做焰色反应的铁丝 |
| D、镁合金的硬度和强度均高于纯镁 |
下列有关铝化合物说法正确的是( )
| A、氧化铝的熔点很高,所以不可以用来冶炼铝 |
| B、氢氧化铝可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,所以明矾可用作净水剂 |
| C、实验室可以用过量氢氧化钠与氯化铝来制备氢氧化铝 |
| D、氢氧化铝既可与酸反应又可与碱反应,是两性氢氧化物 |
下列物质中含有自由移动的Cl-的是( )
| A、KClO3溶液 |
| B、KCl溶液 |
| C、氯气(Cl2) |
| D、NaCl固体 |
下列仪器常用于物质分离的是( )
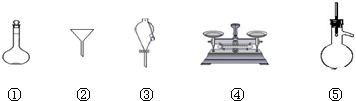

| A、①④⑤ | B、②④⑤ |
| C、②③⑤ | D、①③⑤ |