题目内容
19.恒温恒容下向2L密闭容器中加入SO3发生反应:2SO3(g)?2SO2(g)+O2(g),反应过程中测定的部分数据如下表:下列说法正确的是( )| 反应时间/min | n(SO3)/mol | n(O2)/mol |
| 0 | 2.0 | 0 |
| 2 | 0.8 | |
| 4 | 0.6 | |
| 6 | 1.8 | 1.1 |
| A. | 0~2 min平均速率v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 4 min后,平衡移动的原因可能是减压 | |
| C. | 若升高温度后的平衡常数的值为1.0,则该正反应为吸热反应 | |
| D. | 若起始时容器中SO3的物质的量改为1.0 mol,则平衡时n(SO2)=0.6 mol |
分析 2min时n(SO3)=0.8mol,则反应消耗三氧化硫的物质的量为2.0mol-0.8mol=1.2mol,此时生成氧气的物质的量为:n(O2)=$\frac{1}{2}$n(SO3)=1.2mol×$\frac{1}{2}$=0.6mol,而4min时氧气的物质的量仍然为0.6mol,说明该反应在2min 时已经达到平衡状态,
A.根据v=$\frac{△c}{△t}$计算出0~2 min平均速率v(SO3),然后利用二者计量数关系得出0~2 min平均速率v(SO2);
B.将氧气按照计量数关系转化成三氧化硫可知,改变条件下三氧化硫的物质的量增大了,而减压不影响三氧化硫的物质的量;
C.利用化学平衡三段式列式计算出原平衡时的平衡常数,然后利用温度对平衡常数的影响判断反应热;
D.减小三氧化硫的物质的量,减小了压强,平衡向着正向移动,二氧化硫的物质的量增大.
解答 解:2min时n(SO3)=0.8mol,则反应消耗三氧化硫的物质的量为2.0mol-0.8mol=1.2mol,此时生成氧气的物质的量为:n(O2)=$\frac{1}{2}$n(SO3)=1.2mol×$\frac{1}{2}$=0.6mol,而4min时氧气的物质的量仍然为0.6mol,说明该反应在2min 时已经达到平衡状态,
A.0~2 min平均速率v(SO3)=$\frac{△c}{△t}$=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3 mol•L-1•min-1,化学反应速率与化学计量数成正比,则v(SO2)=v(SO3)=0.3 mol•L-1•min-1,故A错误;
B.将1.1mol氧气按照计量数关系转化成三氧化硫可知,改变条件下三氧化硫的物质的量为:1.8mol+1.1mol×$\frac{1}{2}$=2.35mol>2mol,说明平衡移动的原因为加入了三氧化硫,而不是改变了压强,故B错误;
C.2SO3(g)?2SO2(g)+O2(g),
开始(mol):2mol 0 0
变化(mol):1.2 1.2 0.6
平衡(mol):0.8 1.2 0.6,
原条件下的平衡常数K=$\frac{(\frac{1.2}{2})^{2}×(\frac{0.6}{2})}{(\frac{0.8}{2})^{2}}$=0.675<1,说明升高温度后平衡向着正向移动,则正反应为吸热反应,故C正确;
D.若起始时容器中SO3的物质的量改为1.0 mol,假如平衡不一定,则平衡时n(SO2)=1.2mol×$\frac{1}{2}$=0.6 mol,由于三氧化硫的物质的量减小,相当于减小了压强,平衡向着正向移动,则重新达到平衡时二氧化硫的物质的量大于0.6mol,故D错误;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,正确判断2min后该反应达到平衡状态为解答关键,注意掌握化学平衡常数、化学反应速率的概念及表达式,试题培养了学生的分析能力及化学计算能力.

| A. | 干电池 | B. | 铅蓄电池 | C. | 燃料电池 | D. | 锂离子电池 |
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=-269.8kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO;△H=+116.2kJ/mol(反应热) |
| A. | AgCl在饱和NaCl溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP (AgCl)<KSP (AgBr) | |
| C. | 将0.001 mol•L- 1 的AgNO3 溶液滴入0.001 mol•L- 1 的KCl和0.001 mol•L- 1 的K2CrO4 溶液中先产生Ag2CrO4 沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
反应时间(t)与容器内气体总压强(p)的数据见表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
(1)欲提高A的平衡转化率,应采取的措施为升高温度、降低压强;(写出两项措施).
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为($\frac{P}{{P}_{0}}$-1)×100%.平衡时A的转化率为94.1%,列式并计算反应的平衡常数K1.5mol/L.
(3)由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=$\frac{0.10P}{{P}_{0}}$ mol,n(A)=0.10×(2-$\frac{P}{P0}$) mol.
| t/min | 1 | 4 | 8 | 11 |
| n(H2)mol | 6 | 2.6 | 2 | 2 |
(2)达到平衡时速率之比V(CO2):V(H2):V(CH3OH):V(H2O)=1:3:1:1
(3)达到平衡时,H2的转化率为75%,CO2平衡浓度是2mol/L
(4)其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数(填变大,不变,减小)减小
(5)该温度下,该反应的平衡常数为0.5
(6)达到平衡时降低温度,平衡向正反应移动,达到平衡时速率与原平衡速率比较(填变大,不变,减小)减小.
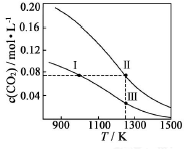 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>3P总(状态Ⅰ) | |
| C. | 体系中c(CO2):c(CO2,状态Ⅱ)<3c(CO2,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
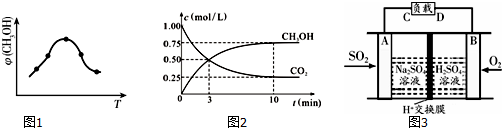
 工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.
工业上设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到宝贵的能源物质.为了探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)的浓度随时间的变化关系如图所示.