题目内容
1.已知:根据离子反应,碳酸根离子与钡离子产生碳酸钡沉淀,硫酸根离子与钡离子产生硫酸钡沉淀,而碳酸钡能与盐酸反应,硫酸钡不溶.现取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀盐酸处理后沉淀量减少到4.66g,并有气体放出.试计算:
(1)所得白色沉淀中BaCO3的物质的量;
(2)原混合液中Na2CO3的物质的量浓度;
(2)产生的气体在标准状况下的体积.
分析 根据Na2CO3、Na2SO4 均能与BaCl2 溶液反应产生BaCO3和BaSO4沉淀共14.51 g,BaCO3 沉淀可溶于盐酸,所以m(BaCO3)=14.51-4.66=9.85g,再根据Na2CO3+BaCl2=BaCO3↓+2NaCl计算.
解答 解:Na2CO3、Na2SO4 均能与BaCl2 溶液反应产生BaCO3和BaSO4沉淀共14.51 g,BaCO3 沉淀可溶于盐酸,所以
m(BaCO3)=14.51-4.66=9.85g,则有n(BaCO3)=$\frac{9.85g}{197g/mol}$=0.05mol
Na2CO3+BaCl2=BaCO3↓+2NaCl
1 mol 1 mol
n(Na2CO3) 0.05mol
解得:n(Na2CO3)=0.05 mol c(Na2CO3)=$\frac{0.05mol}{0.05L}$=1.0 mol•L-1,
BaCO3+2HCl=BaCl2+CO2↑+H2O
1 mol 22.4 L
0.05 mol V(CO2)
V=$\frac{0.05×22.4L}{1}$=1.12L
答:(1)所得白色沉淀中BaCO3的物质的量为0.05mol;
(2)原混合液中Na2CO3的物质的量浓度为1.0 mol•L-1;
(2)产生的气体在标准状况下的体积为1.12L.
点评 本题考查方程式的相关计算,抓住碳酸钡能与盐酸反应,硫酸钡不溶即可解题,题目难度中等.

某学生用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)若移取20.00mL待测液注入有水的锥形瓶中,会导致结果(填“偏大”、“偏小”或“无影响”) 。
(3)判断滴定终点的现象是: 。

(4)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(5)根据下列数据:
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 0.00 | 22.60 |
第三次 | 20.00 | 4.00 | 24.00 |
请计算待测盐酸溶液的浓度: mol/L。
 ,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体的数目为( )
,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体的数目为( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
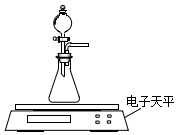 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.(1)甲同学拟测定CaCO3固体与过量0.1mol•L-1 HCl的反应速率.
①该反应的离子方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
②设计实验方案:通过测量生成二氧化碳的体积和反应时间或消耗碳酸钙固体的质量和反应时间计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1mol•L-1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定生成等质量二氧化碳所需时间
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①-⑥所代表的必要数据或物理量
| 物理量 实验序号 | V(0.1mol•L-1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
| 实验1 | a | b | 0 | c | d | |
| 实验2 | ① | 0 | ③ | c | d | |
| 实验3 | c | ② | 0 | ④ | d |
| A. | 摩尔质量为17 g•mol-1 | |
| B. | 所含的分子数目约为9.03×1023 | |
| C. | 在标准状况下体积约为33.6L | |
| D. | 溶于水制成0.5L溶液时物质的量浓度为1.5mol•L-1 |
 ;
;