题目内容
16.按要求准确表达下列变化过程中的化学用语,写出下列(1)-(3)反应的离子方程式和(4)-(5)反应的化学方程式:(1)金属钠与水反应2Na+2H2O=2Na++2OH-+H2↑
(2)氯气与水反应Cl2+H2O?H++Cl-+HClO
(3)氢氧化钠溶液滴入氯化铁溶液中3OH-+Fe3+=2Fe(OH)3↓
(4)漂白粉溶液中通入少量二氧化碳Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(5)呼吸面具(过氧化钠为制氧剂)发生的主要反应2Na2O2+2CO2=2Na2CO3+O2.
分析 (1)钠与水反应生成NaOH和氢气;
(2)氯气与水反应生成盐酸和HClO;
(3)发生复分解反应生成氢氧化铁和氯化钠;
(4)反应生成碳酸钙混合HClO;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气.
解答 解:(1)钠与水反应生成NaOH和氢气,离子反应为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(2)氯气与水反应生成盐酸和HClO,离子反应为Cl2+H2O?H++Cl-+HClO,故答案为:Cl2+H2O?H++Cl-+HClO;
(3)发生复分解反应生成氢氧化铁和氯化钠,离子反应为3OH-+Fe3+=2Fe(OH)3↓,故答案为:3OH-+Fe3+=2Fe(OH)3↓;
(4)反应生成碳酸钙混合HClO,化学反应方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气,化学反应方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查离子反应方程式及化学方程式的书写,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
4.下列电子排布式中不正确的是( )
| A. | 1s22s22p63s23p63d104s1 | B. | 1s22s22p63s23p63d64s2 | ||
| C. | 1s22s22p63s23p63d34s2 | D. | 1s22s22p63s23p63d44s2 |
11.某溶液中含有Ag+、Cu2+、Mg2+、Ba2+、Al3+等离子,要使这些离子逐一沉淀分离,所加试剂及顺序正确的是( )
| A. | H2SO4→HCl→K2S→NaOH→CO2 | B. | NaCl→Na2SO4→Na2S→NH3•H2O→HCl | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→HCl | D. | NaCl→Na2SO4→H2S→NaOH→CO2 |
8.25℃时,PH=11的NaOH溶液和NaCN溶液中,由水电离出的c(OH-)的关系( )
| A. | 相等 | B. | 后者是前者的11倍 | ||
| C. | 后者是前者的108 | D. | 前者是后者的108 |
5.下面是四位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
| A. | 使用催化剂,可加快反应速率,目的是提高生产效率 | |
| B. | 使用冰箱保存食物,是利用了化学反应速率理论 | |
| C. | 化学反应速率理论是研究怎样提高原料转化率 | |
| D. | 化学平衡理论是研究怎样使用有限原料多出产品 |
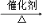 CH3CH2Cl
CH3CH2Cl CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3 已知Zn+CuSO4═Cu+ZnSO4,设计原电池:构造如图1所示,试问ZnSO4溶液放在甲(填“甲”或“乙”)烧杯,盐桥中的离子向两端烧杯移动,构成闭合回路,K+移向乙(填“甲”或“乙”)烧杯.
已知Zn+CuSO4═Cu+ZnSO4,设计原电池:构造如图1所示,试问ZnSO4溶液放在甲(填“甲”或“乙”)烧杯,盐桥中的离子向两端烧杯移动,构成闭合回路,K+移向乙(填“甲”或“乙”)烧杯.