题目内容
10.关于1.5mol NH3的说法错误的是( )| A. | 摩尔质量为17 g•mol-1 | |
| B. | 所含的分子数目约为9.03×1023 | |
| C. | 在标准状况下体积约为33.6L | |
| D. | 溶于水制成0.5L溶液时物质的量浓度为1.5mol•L-1 |
分析 A.氨气的相对分子质量为17,其摩尔质量为17g/mol;
B.根据N=nNA计算出含有的分子数;
C.根据V=nVm计算出氨气在标准状况下的体积;
D.根据c=$\frac{n}{V}$计算出所得溶液的浓度.
解答 解:A.NH3的摩尔质量与物质的量大小无关,其摩尔质量为17 g•mol-1,故A正确;
B.1.5mol NH3所含的分子数目约为:6.02×1023mol-1×1.5mol=9.03×1023,故B正确;
C.在标准状况下体积约为:22.4L/mol×1.5mol=33.6L,故C正确;
D.溶于水制成0.5L溶液时物质的量浓度为:$\frac{1.5mol}{0.5L}$=3mol•L-1,故D错误;
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、摩尔质量、物质的量浓度等物理量之间的关系即可解答,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.现有反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1.
(1)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(2)已知在一定温度下:
C(s)+CO2(g)?2CO (g) 平衡常数K1;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K2;
CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常数K;
则K1、K2、K之间的关系是K=$\frac{{K}_{2}}{{K}_{1}}$.
(3)某催化反应室中发生的反应为:
CH4(g)+H2O(g)═CO(g)+3H2(g)△H1=+216kJ•mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H2
已知CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-44kJ•mol-1,则△H2=+260 kJ•mol-1.
(4)某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如表:
①写出大试管中发生反应的化学方程式:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,该反应是放热反应(填放热或吸热).
②实验结果表明,催化剂的催化效果与催化剂接触面积 有关.
(1)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(2)已知在一定温度下:
C(s)+CO2(g)?2CO (g) 平衡常数K1;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K2;
CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常数K;
则K1、K2、K之间的关系是K=$\frac{{K}_{2}}{{K}_{1}}$.
(3)某催化反应室中发生的反应为:
CH4(g)+H2O(g)═CO(g)+3H2(g)△H1=+216kJ•mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H2
已知CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-44kJ•mol-1,则△H2=+260 kJ•mol-1.
(4)某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如表:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
②实验结果表明,催化剂的催化效果与催化剂接触面积 有关.
18.下列说法中正确的是( )
| A. | O2的摩尔质量是32g | B. | 氯化钠的相对原子质量是58.5g | ||
| C. | 1molH2O的质量是18g | D. | 1molH2O含有氢原子的个数2个 |
5.下面是四位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
| A. | 使用催化剂,可加快反应速率,目的是提高生产效率 | |
| B. | 使用冰箱保存食物,是利用了化学反应速率理论 | |
| C. | 化学反应速率理论是研究怎样提高原料转化率 | |
| D. | 化学平衡理论是研究怎样使用有限原料多出产品 |

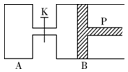 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题: