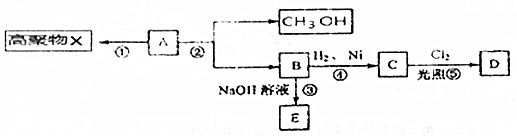
题目内容
6.用石墨电极电解CuCl2溶液(装置如图所示),下列相关分析正确的是( )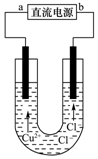
| A. | a端是直流电源的正极 | |
| B. | 阴极上发生的反应:Cu2++2e-=Cu | |
| C. | 通电使CuCl2发生电离 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |
分析 由铜离子移动方向可知a为负极,b为正极,连接电源负极的电极为电解池的阴极,发生还原反应,连接电源正极的电极为电解池的阳极,发生氧化反应,结合电极方程式解答该题.
解答 解:A.由装置图可知,铜离子移向的电极为阴极,阴极和电源负极相连,a为负极,故A错误;
B.阴极电极方程式为Cu2++2e-=Cu,故B正确;
C.电离过程是电解质在水分子作用下发生的离解过程,不是通电条件,通电使电解质发生氧化还原反应,故C错误;
D.氯离子在阳极失电子生成氯气,通电一段时间后,在阳极附近观察到黄绿色气体,故D错误;
故选B.
点评 本题考查电解池知识,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握铜离子的定向移动,判断电源的正负极为解答该题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14. 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成Cu而使Cu2O产率降低.
(2)已知:2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=-(a+b-2c)kJ•mol-1.
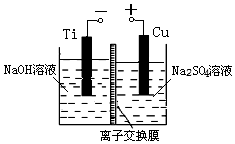
(3)方法Ⅱ通过采用离子交换膜控制电解液中OH-浓度的方法来制备纳米级Cu2O,电解装置如图所示.
①阴极上的还原产物是H2.
②已知阳极生成Cu2O,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
③Na2SO4溶液的主要作用是增强溶液的导电性.
(4)方法Ⅲ是在加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(5)肼又称联氨,请写出肼的电子式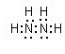 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
(6)已知在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(7)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑,电池工作一段时间后,电解质溶液的pH将减小(填“增大”、“减小”、“不变”).
 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)已知:2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=-(a+b-2c)kJ•mol-1.
(3)方法Ⅱ通过采用离子交换膜控制电解液中OH-浓度的方法来制备纳米级Cu2O,电解装置如图所示.
①阴极上的还原产物是H2.
②已知阳极生成Cu2O,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
③Na2SO4溶液的主要作用是增强溶液的导电性.
(4)方法Ⅲ是在加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(5)肼又称联氨,请写出肼的电子式
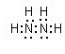 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.(6)已知在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(7)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑,电池工作一段时间后,电解质溶液的pH将减小(填“增大”、“减小”、“不变”).
1.进行化学实验必须注意安全,下列说法不正确的是( )
| A. | 不慎将酸液溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 洒在桌面上的酒精燃烧,立即用湿抹布盖灭 | |
| D. | 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
11.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.1g37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78g | |
| C. | 7.8g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24L乙烷含有的共价键数为1.9NA |
18.下列各组离子在指定溶液中一定不能大量共存的是( )
| A. | 含有大量Ba2+ 的溶液:Na+、SO42-、NH4+ | |
| B. | 0.1mol/LNa2CO3溶液:K+、AlO2-、Cl-、NO3- | |
| C. | 25°C时pH<7的溶液:K+、Cu2+、Fe3+、NO3- | |
| D. | 遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
15.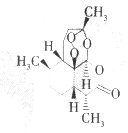 中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )
中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )
 中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )
中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素是芳香族化合物 | |
| C. | 青蒿素分子中含有过氧链、酯基和醚键 | |
| D. | 青蒿素不能发生加成反应 |
18.下列变化的实质相似的是( )
| A. | 浓硫酸与浓盐酸在空气中敞口放置时浓度均减小 | |
| B. | 金属导电与电解质溶液导电 | |
| C. | 在净水过程中分别使用明矾和漂白粉 | |
| D. | 工业上制取金属铁和金属铜 |