题目内容
17.在一定温度下,容积为2L的容器中充入2molSO2和1molO2发生反应:2SO2+O2?2SO3,达到平衡时,容器内气体压强为开始时的70%,试求:①SO2的转化率
②平衡时的O2浓度
③SO3的体积分数.
分析 设转化的氧气为x,则
2SO2+O2?2SO3,
开始 2 1 0
转化 2x x 2x
平衡 2-2x 1-x 2x
达到平衡时,容器内气体压强为开始时的70%,
可知$\frac{2-2x+1-x+2x}{2+1}$=70%,解得x=0.9mol,以此来解答.
解答 解:设转化的氧气为x,则
2SO2+O2?2SO3,
开始 2 1 0
转化 2x x 2x
平衡 2-2x 1-x 2x
达到平衡时,容器内气体压强为开始时的70%,
可知$\frac{2-2x+1-x+2x}{2+1}$=70%,解得x=0.9mol,
①SO2的转化率为$\frac{2×0.9mol}{2mol}$×100%=90%,
答:SO2的转化率为90%;
②平衡时的O2浓度为$\frac{1mol-0.9mol}{2L}$=0.05mol/L,
答:平衡时的O2浓度为0.05mol/L;
③SO3的体积分数为$\frac{2×0.9mol}{2.1mol}$×100%=85.7%,
答:SO3的体积分数为85.7%.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、转化率的计算为解答的关键,侧重分析与计算能力的考查,注意温度、体积不变时物质的量与压强成正比,题目难度不大.

练习册系列答案
相关题目
1.下列装置有关说法错误的是( )
| A. |  装置可以用来验证碳的非金属性比硅强 | |
| B. | 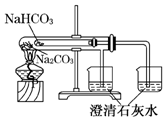 装置可以用来比较Na2CO3和NaHCO3的热稳定性 | |
| C. | 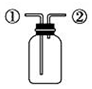 装置先从①口进气收集满二氧化碳,再从②口进气,可收集NO气体 | |
| D. | 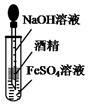 装置制备Fe(OH)2并能保证较长时间观察到白色 |
5.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )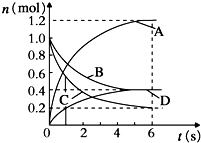

| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的反应速率相等 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
12.下列说法不正确的是( )
| A. | 物质发生化学反应的反应热仅指反应放出的热量 | |
| B. | 热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数 | |
| C. | 所有的燃烧反应都是放热的 | |
| D. | 热化学方程式中,化学式前面的化学计量数可以是分数 |
2.下列颜色变化与氧化还原反应有关的是( )
| A. | 将SO2通入品红溶液中,溶液的红色褪去 | |
| B. | 将5滴氯化铁饱和溶液滴入25mL煮沸的蒸馏水中继续加热,液体变红褐色 | |
| C. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 | |
| D. | 将葡萄糖溶液加入新制Cu(OH)2悬浊液加热至沸腾,出现砖红色沉淀 |
9.我国三峡工程所提供的清洁、廉价、强劲、可再生能源--水电,相当于每年燃烧3000万吨原煤的火力发电厂产生的电能,三峡工程有助于控制( )
①温室效应 ②形成酸雨 ③空气中的固体颗粒浓度 ④白色污染.
①温室效应 ②形成酸雨 ③空气中的固体颗粒浓度 ④白色污染.
| A. | 只有① | B. | 只有①② | C. | ②③④ | D. | ①②③ |
6.用石墨电极电解CuCl2溶液(装置如图所示),下列相关分析正确的是( )
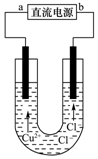

| A. | a端是直流电源的正极 | |
| B. | 阴极上发生的反应:Cu2++2e-=Cu | |
| C. | 通电使CuCl2发生电离 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |
9.已知还原性SO32->I-.某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判正确的是( )
| A. | 肯定不含I- | B. | 肯定含有Na+ | ||
| C. | 肯定不含SO42-肯定含有SO32- | D. | 不能肯定是否含有SO42 |