题目内容
0.1mol?L-1的NH4Cl溶液:
(1)溶液中含有 种离子,其离子浓度大小的顺序为 ;
(2)c(NH4+)+c(NH3?H2O)= mol?L-1;
(3)加入一定量的氨水后,溶液呈中性,此时溶液中c(NH4+) c(Cl-)(填“>”“=”或“<”).
(1)溶液中含有
(2)c(NH4+)+c(NH3?H2O)=
(3)加入一定量的氨水后,溶液呈中性,此时溶液中c(NH4+)
考点:盐类水解的应用
专题:盐类的水解专题
分析:(1)氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,钠离子不水解,据此判断离子浓度大小;
(2)在氯化铵溶液中存在物料守恒;
(3)根据溶液中的电荷守恒来回答.
(2)在氯化铵溶液中存在物料守恒;
(3)根据溶液中的电荷守恒来回答.
解答:
解:(1)氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2O?NH3.H2O+H+,所以c(H+)>c(OH-),铵根离子水解、钠离子不水解,所以c(Cl-)>c(NH4+),铵根离子水解较微弱,所以c(NH4+)>c(H+),所以溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)在氯化铵溶液中存在物料守恒:c(NH4+)+c(NH3?H2O)=c(Cl-)=0.1mol/L,故答案为:0.1;
(3)加入一定量的氨水后,溶液呈中性,c(H+)=c(OH-),据溶液中的电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+),故答案为:=.
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)在氯化铵溶液中存在物料守恒:c(NH4+)+c(NH3?H2O)=c(Cl-)=0.1mol/L,故答案为:0.1;
(3)加入一定量的氨水后,溶液呈中性,c(H+)=c(OH-),据溶液中的电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+),故答案为:=.
点评:本题考查学生盐的水解原理以及溶液中离子浓度之间的大小关系等知识,属于综合知识的考查题,难度中等.

练习册系列答案
相关题目
下列说法中错误的是( )
| A、NaCl溶液焰色反应呈黄色 |
| B、NH3能使湿润的红色石蕊试纸变蓝 |
| C、漂白粉的主要成分是次氯酸钙和氯化钙 |
| D、进行蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
下列实验操作中正确的是( )
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏时,温度计水银球靠近蒸馏烧瓶的底部,且冷却水从冷凝管的下口通入上口流出 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、称量时,将Na2CO3固体直接放在托盘天平的右盘上 |


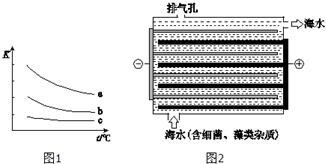 海水是巨大的化学资源宝库.
海水是巨大的化学资源宝库.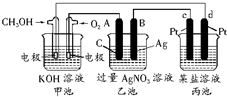 如图所示的装置中,甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
如图所示的装置中,甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.