题目内容
已知光气COCl2的分解反应为COCl2(g)?Cl2(g)+CO(g)△H=+108kJ?mol-1.反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):
①计算反应在地8min时的平衡常数K= ;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
③若12min时反应与温度T(8)下重新达到平衡,则此时c(COCl2)= mol?L-1
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率[平均反应速率分别以v(2-3)、v(5-6)、v(12-13)表示]的大小 ;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6) v(15-16)(填“<”、“>”或“=”),原因是 .

①计算反应在地8min时的平衡常数K=
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)
③若12min时反应与温度T(8)下重新达到平衡,则此时c(COCl2)=
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率[平均反应速率分别以v(2-3)、v(5-6)、v(12-13)表示]的大小
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6)
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
;
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0;
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
| c(CO)c(Cl2) |
| c(COCl2) |
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0;
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
解答:
解:①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=
=
=0.234mol/L,故答案为:0.234mol/L;
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
故答案为:<;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:
=0.23,解得c(COCl2)=0.031mol/L;
故答案为:0.031;
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为:v(5~6)>v(2~3)=v(12~13),故答案为:v(5~6)>v(2~3)=v(12~13);
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),故答案为:>;在相同温度时,该反应的反应物浓度越高,反应速率越大.
| c(CO)c(Cl2) |
| c(COCl2) |
| 0.085×0.11 |
| 0.04 |
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
故答案为:<;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:
| 0.06×0.12 |
| c(COCl2) |
故答案为:0.031;
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为:v(5~6)>v(2~3)=v(12~13),故答案为:v(5~6)>v(2~3)=v(12~13);
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),故答案为:>;在相同温度时,该反应的反应物浓度越高,反应速率越大.
点评:本题考查较综合,涉及电解原理、盖斯定律、化学平衡移动等知识点,难点是化学平衡常数的有关计算,理解图象中曲线变化趋势及曲线变化可能改变的条件是解本题关键,再结合平衡常数公式进行计算,题目难度中等.

练习册系列答案
相关题目
甲烷在氧气中燃烧后生成二氧化碳和水,从该实验事实可以得出的结论是( )
| A、甲烷的分子式为CH4 |
| B、甲烷气体中含碳元素和氢元素 |
| C、甲烷气体中只含碳元素和氢元素 |
| D、甲烷的化学性质比较稳定 |
下列不饱和化合物(单体)能在一定条件下发生加聚反应生成如图所示物质的是:( )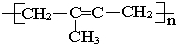
| A、丙烯 |
| B、2-甲基-1,3-丁二烯 |
| C、乙烯和丙烯 |
| D、2-甲基-2-丁烯 |
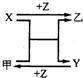 X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题:
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题:
 已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好.
已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好.