题目内容
对如图中两极加以必要的连接并填空:
(1)在如图A中,使铜片上产生氢气.
①若加以导线连接,则连接后的装置叫 (填“原电池”或“电解池”).锌片发生 (填“氧化”或“还原”);铜片上的电极反应式: .
②若外加电源,则连接后的装置叫 (填“原电池”或“电解池”),其中铜片作为该装置的 极,连接电源的 极;锌片上发生的电极反应式为 .
(2)在如图B中,使a极析出铜.
①若a、b电极均为石墨电极并加以必要的连接,则连接后的装置应为 (填“原电池”或“电解池”);该装置工作时,溶液中阴离子向 极作定向移动(填“a”或“b”); 经过一段时间后,停止反应并搅匀溶液,溶液的酸性 (填“增强”、“降低”或“不变”).
②若a、b电极加以导线连接,且a极为铜电极,则b极可以为 电极(填序号).
A.铂 B.铁 C.石墨 D.银 E.锌
该装置工作时,溶液中阴离子向 极作定向移动(填“a”或“b”).
(1)在如图A中,使铜片上产生氢气.

①若加以导线连接,则连接后的装置叫
②若外加电源,则连接后的装置叫
(2)在如图B中,使a极析出铜.
①若a、b电极均为石墨电极并加以必要的连接,则连接后的装置应为
②若a、b电极加以导线连接,且a极为铜电极,则b极可以为
A.铂 B.铁 C.石墨 D.银 E.锌
该装置工作时,溶液中阴离子向
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)①将锌、铜用导线连接后,该装置符合原电池的构成条件而形成原电池,锌易失电子而作负极,铜作正极;
②若外加电源,则为电解池,阴极上氢离子得电子生成氢气,则Cu为阴极,与电源负极相连,Zn为阳极,则锌片失电子生成锌离子;
(2)在①B图中(a,b都为惰性电极),使a极析出铜,电极材料不能得失电子,所以该装置是电解池,a是阴极,b是阳极,阳极上氢氧根离子放电生成氧气;电解池中阴离子向阳极移动;根据电解方程式判断溶液酸碱性变化;
②若a、b电极加以导线连接,则构成原电池,使a极析出铜,则a为正极,b为负极,b电极的活泼性比Cu强;原电池中阴离子向负极移动.
②若外加电源,则为电解池,阴极上氢离子得电子生成氢气,则Cu为阴极,与电源负极相连,Zn为阳极,则锌片失电子生成锌离子;
(2)在①B图中(a,b都为惰性电极),使a极析出铜,电极材料不能得失电子,所以该装置是电解池,a是阴极,b是阳极,阳极上氢氧根离子放电生成氧气;电解池中阴离子向阳极移动;根据电解方程式判断溶液酸碱性变化;
②若a、b电极加以导线连接,则构成原电池,使a极析出铜,则a为正极,b为负极,b电极的活泼性比Cu强;原电池中阴离子向负极移动.
解答:
解:(1)①在A图中,使铜片上冒H2气泡,则铜片作正极,锌作负极,该电池属于原电池,锌电极上失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,电极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:原电池;氧化;2H++2e-=H2↑;
②若外加电源,则为电解池,阴极上氢离子得电子生成氢气,则Cu为阴极,与电源负极相连,Zn为阳极,则锌片失电子生成锌离子,其电极反应为:Zn-2e-=Zn2+;
故答案为:电解池;阴极;负极;Zn-2e-=Zn2+;
(2)①在B图中(a,b都为惰性电极),使a极析出铜,电极材料不能得失电子,所以该装置是电解池,a是阴极,阴极上铜离子得电子发生还原反应,b是阳极,阳极上氢氧根离子放电生成氧气,溶液中阴离子向阳极即b极移动,电池总反应为:2Cu(NO3)2+2H2O
2Cu+O2↑+4HNO3,反应时溶液酸性增强;
故答案为:电解池;b;增强;
②若a、b电极加以导线连接,则构成原电池,使a极析出铜,则a为正极,b为负极,b电极的活泼性比Cu强,所以b电极可以选用铁和锌;原电池中阴离子向负极移动,即阴离子向b极移动;
故答案为:B、E;b.
故答案为:原电池;氧化;2H++2e-=H2↑;
②若外加电源,则为电解池,阴极上氢离子得电子生成氢气,则Cu为阴极,与电源负极相连,Zn为阳极,则锌片失电子生成锌离子,其电极反应为:Zn-2e-=Zn2+;
故答案为:电解池;阴极;负极;Zn-2e-=Zn2+;
(2)①在B图中(a,b都为惰性电极),使a极析出铜,电极材料不能得失电子,所以该装置是电解池,a是阴极,阴极上铜离子得电子发生还原反应,b是阳极,阳极上氢氧根离子放电生成氧气,溶液中阴离子向阳极即b极移动,电池总反应为:2Cu(NO3)2+2H2O
| ||
故答案为:电解池;b;增强;
②若a、b电极加以导线连接,则构成原电池,使a极析出铜,则a为正极,b为负极,b电极的活泼性比Cu强,所以b电极可以选用铁和锌;原电池中阴离子向负极移动,即阴离子向b极移动;
故答案为:B、E;b.
点评:本题考查了原电池和电解池原理,明确原电池和电解池各个电极上得失电子及发生的电极反应是解本题关键,再结合溶液中离子浓度变化来分析解答,难度中等.

练习册系列答案
相关题目
对下列实验过程的评价,正确的是( )
| A、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| B、某溶液中滴加BaCl2溶液,生成不溶于水稀HNO3的白色沉淀,证明一定含有SO42- |
| C、验证烧碱溶液中是否含Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- |
| D、某无色溶液滴入石蕊试液显红色,该溶液一定是碱溶液 |
已知aL硫酸铝溶液中,含有27g A13+,取0.5aL硫酸铝溶液稀释至2aL,则稀释后溶液中SO42ˉ的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
150℃时,某白色固体完全分解为NH3、H2O、CO2三种物质,此时该混合气对氢气的相对密度为12.7,则( )
| A、该白色粉末为NH4HCO3 |
| B、该白色粉末为(NH4)2CO3 |
| C、该白色粉末为NH4HCO3与(NH4)2CO3 混合物且物质的量之比为1:2 |
| D、该白色粉末为NH4HCO3与(NH4)2CO3 混合物且物质的量之比为2:1 |
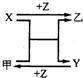 X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题:
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系.回答下列问题: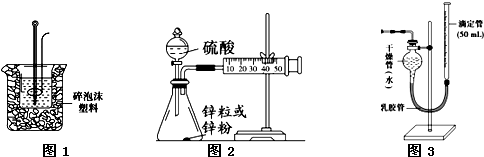
 已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好.
已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好.