题目内容
用NA表示阿伏伽德罗常数的数值.下列说法正确的是( )
| A、1L 1mol?L-1的NH4NO3溶液中氮原子数小于2NA |
| B、常温常压下,11.2g乙烯中含有共用电子对数目为2.4NA |
| C、在O2参加的反应中,1molO2作氧化剂时得到的电子数一定是4NA |
| D、标准状况下,22.4LCCl4中所含有的分子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.1L1mol/L的NH4NO3溶液中含有溶质硝酸铵1mol,1mol硝酸铵中含有2mol氮原子;
B.根据乙烯的结构计算出含有的共用电子对数目;
C.氧气和钠反应可以生成氧化钠,也可以生成过氧化钠;
D.气体摩尔体积只适应气体.
B.根据乙烯的结构计算出含有的共用电子对数目;
C.氧气和钠反应可以生成氧化钠,也可以生成过氧化钠;
D.气体摩尔体积只适应气体.
解答:
解:A.1L1mol/L的NH4NO3溶液中含有溶质硝酸铵1mol,1mol硝酸铵中含有2mol氮原子,故A错误;
B.11.2g乙烯的物质的量为:
=0.4molmol,含有1.6mol碳氢键和0.4mol碳碳键,总共含有2.4mol共用电子对,含有共用电子对数目为2.4NA,故B正确;
C.氧气和钠反应可以生成氧化钠,也可以生成过氧化钠,1mol O2与金属钠反应,反应生成氧化钠电子转移4mol,生成过氧化钠电子转移1mol,O2不一定得到4NA个电子,故C错误;
D.标况下,四氯化碳为液态,不能使用气体摩尔体积,故D错误;
故选:B.
B.11.2g乙烯的物质的量为:
| 11.2g |
| 28g/mol |
C.氧气和钠反应可以生成氧化钠,也可以生成过氧化钠,1mol O2与金属钠反应,反应生成氧化钠电子转移4mol,生成过氧化钠电子转移1mol,O2不一定得到4NA个电子,故C错误;
D.标况下,四氯化碳为液态,不能使用气体摩尔体积,故D错误;
故选:B.
点评:本题考查阿伏加德罗常数的有关计算和判断,注意明确标况下气体摩尔体积的使用条件,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
运用相关化学知识进行判断,下列结论错误的是( )
| A、可燃冰主要由甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| B、增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
| C、某吸热反应能自发进行,因此该反应是熵增反应 |
| D、NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
某烃的结构简式为 ,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )
,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )
 ,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )
,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )| A、4、4、5 |
| B、2、5、4 |
| C、4、3、6 |
| D、4、6、4 |
下列有关物质性质、应用的说法正确的是( )
| A、氯化铝是电解质,可电解其水溶液获得金属铝 |
| B、二氧化硅具有导电性,可用于生产光导纤维 |
| C、SO2具有漂白性,可用于将银耳漂白为“雪耳” |
| D、小苏打可与酸反应,可用作治疗胃酸过多的药剂 |
下列关于化学反应速率的说法中,正确的是( )
| A、对于任何化学反应来说,反应速率越快,反应现象就越明显 |
| B、化学反应速率为0.8 mol/(L?s)是指1秒钟时某物质的浓度为0.8 mol/L |
| C、根据化学反应速率的大小可以知道化学反应进行的快慢 |
| D、化学反应速率是指一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 |
下列有关化学用语表示正确的是( )
①CSO的电子式: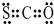
②次氯酸结构简式:H-Cl-O
③Cl-的结构示意图: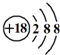
④甲烷分子的比例模型:
⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:
Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+.
①CSO的电子式:
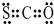
②次氯酸结构简式:H-Cl-O
③Cl-的结构示意图:

④甲烷分子的比例模型:

⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:
20 17 |
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+.
| A、①④⑤ | B、②③④⑥ |
| C、③⑤⑥⑦ | D、全部正确 |
I2(g)+H2(g)?2HI(g)△H<0,在其他条件不变的情况下正确说法是( )
| A、加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B、改变压强,平衡不发生移动,反应放出的热量不变 |
| C、升高温度,反应速率加快,反应放出的热量不变 |
| D、若在原电池中进行,反应放出的热量不变 |
 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问: