题目内容
4.某气体的摩尔质量为Mg/mol NA表示阿伏伽德罗常数的值,在一定温度和压强下,体积为VL的该气体所含的分子数为x,MX/VNA表示的是( )| A. | 以为单位1L 该气体的质量 | B. | 以“克”为单位,VL该气体的质量 | ||
| C. | 1L该气体中所含的分子数 | D. | 以“升”为单位 1mol该气体的体积 |
分析 在一定的温度和压强下,体积为VL的该气体所含有的分子数为X,则气体的物质的量为$\frac{X}{{N}_{A}}$,质量为$\frac{MX}{{N}_{A}}$,则$\frac{MX}{V{N}_{A}}$=ρ,以此来解答.
解答 解:A.以g为单位1L该气体的质量即气体的密度为$\frac{X}{{N}_{A}}$mol×M g•mol-1÷VL=$\frac{MX}{V{N}_{A}}$,故A正确;
B.以g为单位VL该气体的质量为$\frac{X}{{N}_{A}}$mol×M g•mol-1,故B错误;
C.1L该气体所含的分子数为$\frac{X}{V}$,故C错误;
D.以L为单位,1mol该气体的体积为$\frac{V{N}_{A}}{X}$L,故D错误;
故选A.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、体积的关系等为解答的关键,侧重分析与应用能力的考查,注意计算公式中各量的关系,题目难度不大.

练习册系列答案
相关题目
15.下列实验正确的是 ( )
| A. | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊,确定NaHCO3溶液中是否混有Na2CO3 | |
| B. | 苯酚沾到皮肤上,先用酒精清洗,再用水冲洗 | |
| C. | 将10g ZnSO4•7H2O溶解在90g水中,配制10%ZnSO4溶液 | |
| D. | 向稀硫酸中加几滴CuSO4溶液,可提高纯锌与稀硫酸的反应速率. |
12.下列有关描述及离子方程式的书写正确的是( )
| A. | HSO3-在溶液中发生水解:HSO3-+H2O?SO32-+H3O+ | |
| B. | 向Mg(OH)2浊液中滴加FeCl3溶液生成红褐色沉淀:3OH-+Fe3+=Fe(OH)3↓ | |
| C. | 碳酸氢钠溶液显碱性:HCO3-+H2O?H2CO3+OH- | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$OH-+Cl2↑+H2↑ |
19.在2L Al2(SO4)3和(NH4)2SO4的混合溶液中加入3mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到3mol NH3,则原溶液中Al3+的浓度为( )
| A. | 0.75 mol/L | B. | 1.5 mol/L | C. | 0.25 mol/L | D. | 0.5 mol/L |
9.下列仪器名称的书写规范且正确的是( )
| A. |  长颈漏斗 | B. |  表面皿 | C. |  三脚架 | D. |  瓷钳锅 |
13.下列有关有机物的性质和用途的说法正确的是( )
| A. | 乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 | |
| B. | 乙烯、聚氯乙烯、苯乙烯分子结构中都含有不饱和键 | |
| C. | 乙醇既可以作燃料,也可以在日常生活中使用,如无水乙醇可用于杀菌、消毒、漂白 | |
| D. | 石油的分馏、裂化和煤的干馏都是化学变化 |
14.下列说法中,正确的是( )
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{14}$C原子的中子数相等 | |
| B. | 纯水在20℃比在90℃时的pH值小 | |
| C. | 正常雨水PH等于7,酸雨的PH小于7 | |
| D. | 次氯酸是一种强氧化剂,是一种弱酸 |
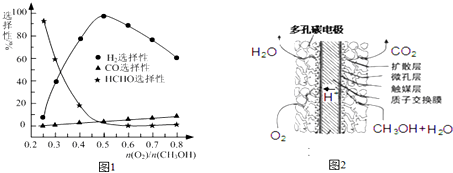
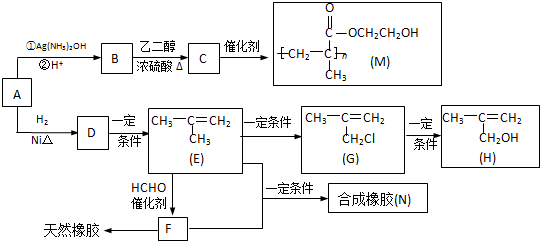
 ;
; .
.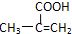 ,该不饱和酸有多种同分异构体,属于酯类且含有碳碳双键的同分异构体共有5种.
,该不饱和酸有多种同分异构体,属于酯类且含有碳碳双键的同分异构体共有5种.