题目内容
摩尔是表示 的单位,每摩尔物质均含有 个粒子.12g 12C中含有的碳原子数约为 个,1mol H2O分子约含有 个电子,9g H2O含有 mol电子.
考点:物质的量的相关计算
专题:计算题
分析:物质的量的单位是摩尔;1mol物质中含有阿伏伽德罗常数个该物质的粒子;6.02×1023为阿伏伽德罗常数的近似值;科学上规定,0.012Kg即12g12C含有的碳原子数就是阿伏加德罗常数;1mol水中含有10mol电子,根据n=
计算.
| m |
| M |
解答:
解:物质的量是表示微观粒子与宏观可称量物质联系起来的一种物理量,单位是摩尔;
1mol物质中含有阿伏伽德罗常数个该物质的粒子,6.02×1023是阿伏伽德罗常数的近似值;
科学上规定,0.012Kg即12g12C含有的碳原子数就是阿伏加德罗常数,.12g 12C中含有的碳原子数约为6.02×1023个;
1mol水中含有10mol电子,N=n×NA=10NA,9g H2On(H2O)=
=
=0.5mol,含有5mol电子,
故答案为:物质的量;NA;6.02×1023;10NA;5;
1mol物质中含有阿伏伽德罗常数个该物质的粒子,6.02×1023是阿伏伽德罗常数的近似值;
科学上规定,0.012Kg即12g12C含有的碳原子数就是阿伏加德罗常数,.12g 12C中含有的碳原子数约为6.02×1023个;
1mol水中含有10mol电子,N=n×NA=10NA,9g H2On(H2O)=
| m |
| M |
| 9g |
| 18g/mol |
故答案为:物质的量;NA;6.02×1023;10NA;5;
点评:本题考查了物质的量的单位-摩尔、阿伏伽德罗常数,题目难度不大,注意掌握物质的量的单位、阿伏伽德罗常数的概念,明确物质的量与摩尔、阿伏伽德罗常数与6.02×1023之间的关系是解答关键.

练习册系列答案
相关题目
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)?4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A、该反应的化学平衡常数表达式是K=
| ||
| B、此时,B的平衡转化率是35% | ||
| C、增大该体系的压强,平衡向右移动,化学平衡常数 | ||
| D、增加C,B的平衡转化率不变 |
下列依据相关数据作出的推理和判断中,不正确的是( )
| A、依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| B、依据溶解度数据,选择用萃取的方法将粗溴提纯 |
| C、依据沸点数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D、依据苯与氢气加成反应的反应热数据与其他烯烃的加成反应对比,研究苯化学键的特征 |
下列说法中正确的是( )
| A、某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑的气体,证明该固体一定含有CO32- |
| B、某无色溶液滴加酚酞试液显红色,该溶液不一定是碱 |
| C、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| D、某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红气体,说明原溶液中存在NH4+ |
Na2O2可发生反应:①2Na2O2+2H2O=4NaOH+O2↑ ②2Na2O2+2CO2=2Na2CO3+O2 ③2Na2O2+4HCl=4NaCl+2H2O+O2↑ 由此可判断Na2O2( )
| A、是碱性氧化物 |
| B、可置于呼吸面具中提供O2 |
| C、无须密封保存 |
| D、投入水中会使溶液变红色 |
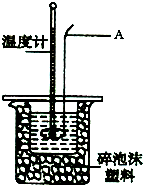 某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.
某实验小组用0.50mol?L-1NaOH溶液和0.50mol?L-1.1硫酸溶液进行中和热的测定.