题目内容
10.羟基是一种重要的官能团.某化学兴趣小组以①碳酸 ②苯酚 ③乙酸3种物质的溶液作为研究对象,通过实验来比较不同物质的羟基中氢原子的活泼性.
某同学设计并实施了如下实验方案,请完成有关填空.
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取3种溶液,滴加紫色石蕊溶液 | 溶液会变红的是①③ | |
| 2 | 用足量的乙酸溶液浸泡碳酸钙 | 有关反应的化学方程式为CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑ | |
| 3 | 将CO2通入苯酚钠溶液中 | 有关反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+NHCO3- | |
| 结论:3种物质的羟基中的氢原子的活泼性由强到弱的顺序是③①②(填序号) | |||
分析 苯酚的酸性比碳酸弱,所以将CO2通入C6H5ONa溶液中,生成苯酚;足量的乙酸溶液浸泡碳酸钙生成醋酸钙、水以及二氧化碳,据此回答.
解答 解:比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验目的是证明酸性:乙酸>碳酸>苯酚.根据强酸制取弱酸的原则,须设计酸性:乙酸>碳酸>苯酚,苯酚酸性极弱,不能是石蕊变色,醋酸和碳酸能使石蕊变红,乙酸和碳酸钙反应生成醋酸钙、水以及二氧化碳,证明乙酸酸性强于碳酸,将CO2通入苯酚钠溶液中生成苯酚,证明碳酸酸性强于苯酚,3种物质的羟基中的氢原子的活泼性由强到弱的顺序是③①②.故答案为:CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑;C6H5O-+CO2+H2O→C6H5OH+HCO3-;③①②.
点评 本题考查了苯酚的性质,注意酸性:乙酸>碳酸>苯酚,实验设计根据实验目的进行设计.

练习册系列答案
相关题目
20.现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是③
①分液、萃取、蒸馏 ②萃取、蒸馏、分液 ③分液、蒸馏、萃取 ④蒸馏、萃取、分液.
①分液、萃取、蒸馏 ②萃取、蒸馏、分液 ③分液、蒸馏、萃取 ④蒸馏、萃取、分液.
18.在 KNO3+S+C→K2S+N2+CO2反应中,被1mol KNO3氧化的碳的质量是( )
| A. | 21g | B. | 18g | C. | 15g | D. | 12g |
15.在一可变容积的密闭容器中进行反应:C(s)+H2O(g)?CO(g)+H2(g),下列条件的改变对反应速率几乎无影响的是( )
| A. | 增加H2O(g) 的量 | |
| B. | 增加C(s)的量 | |
| C. | 将容器的体积缩小一半 | |
| D. | 保持压强不变,充入N2,使容器的体积变大 |
9.下列说法正确的是( )
| A. | 按系统命名法,化合物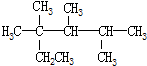 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| B. | 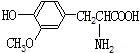 与 与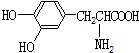 都是α-氨基酸且互为同系物 都是α-氨基酸且互为同系物 | |
| C. | 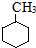 的一溴代物和 的一溴代物和 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| D. | CH3CH═CHCH3分子中的四个碳原子在同一平面上 |