题目内容
部分弱酸在水溶液中的电离平衡常数如下表
下列选项正确的是( )
| 弱酸 | 氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
| 电离平衡常数K (25℃) |
K=4.93×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
K=3.53×10-4 |
| A、NaCN溶液中通入少量CO2:CN-+H2O+CO2→HCN+HCO3- |
| B、Na2CO3溶液中通入少量HF:CO32-+2HF→2F-+CO2+H2O |
| C、25℃,等浓度的NaCN和NaF溶液中pH值前者大于后者 |
| D、中和等体积、等pH的HCN和HF消耗NaOH的量前者小于后者 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.酸性:H2CO3>HCN>HCO3-,强酸能和弱酸的盐反应生成弱酸;
B.酸性HF>H2CO3>HCO3-,二者反应生成碳酸氢钠和氟化钠;
C.酸的电离平衡常数越大,其电离程度越大,则酸根离子水解程度越小,相同浓度的钠盐溶液pH越小;
D.中和等体积、等pH的HCN和HF消耗NaOH的量与酸的物质的量成正比.
B.酸性HF>H2CO3>HCO3-,二者反应生成碳酸氢钠和氟化钠;
C.酸的电离平衡常数越大,其电离程度越大,则酸根离子水解程度越小,相同浓度的钠盐溶液pH越小;
D.中和等体积、等pH的HCN和HF消耗NaOH的量与酸的物质的量成正比.
解答:
解:A.酸性:H2CO3>HCN>HCO3-,强酸能和弱酸的盐反应生成弱酸,二者反应生成氢氰酸和碳酸氢根离子,方程式为CN-+H2O+CO2→HCN+HCO3-,故A正确;
B.酸性HF>H2CO3>HCO3-,二者反应生成碳酸氢钠和氟化钠,离子方程式为CO32-+HF→F-+HCO3-,故B错误;
C.酸的电离平衡常数越大,其电离程度越大,则酸根离子水解程度越小,相同浓度的钠盐溶液pH越小,电离平衡常数HF>HCN,则电离程度:CN->F-,所以等浓度的NaCN和NaF溶液中pH值前者大于后者,故C正确;
D.中和等体积、等pH的HCN和HF消耗NaOH的量与酸的物质的量成正比,等pH的HCN和HF,c(HCN)>c(HF),则等体积等pH的HCN和HF的物质的量前者大于后者,则消耗NaOH的量前者大于后者,故D错误;
故选AC.
B.酸性HF>H2CO3>HCO3-,二者反应生成碳酸氢钠和氟化钠,离子方程式为CO32-+HF→F-+HCO3-,故B错误;
C.酸的电离平衡常数越大,其电离程度越大,则酸根离子水解程度越小,相同浓度的钠盐溶液pH越小,电离平衡常数HF>HCN,则电离程度:CN->F-,所以等浓度的NaCN和NaF溶液中pH值前者大于后者,故C正确;
D.中和等体积、等pH的HCN和HF消耗NaOH的量与酸的物质的量成正比,等pH的HCN和HF,c(HCN)>c(HF),则等体积等pH的HCN和HF的物质的量前者大于后者,则消耗NaOH的量前者大于后者,故D错误;
故选AC.
点评:本题考查了弱电解质的电离,知道电离平衡常数与酸根离子水解程度、酸的强弱之间的关系是解本题关键,根据酸的强弱来确定生成物,注意D中中和等pH、等体积的酸消耗NaOH的体积与酸的强弱无关,只与酸的物质的量有关,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
戊烷(C5H12)的同分异构体共有( )个.
| A、2个 | B、3个 | C、4个 | D、5个 |
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,横坐标表示加入NaOH的体积).根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,横坐标表示加入NaOH的体积).根据图示判断,下列说法正确的是( )| A、当V(NaOH)=40mL时,c(Na+)+c(H+)=2c(A2-)+c(OH-) |
| B、当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| C、滴加过程中当溶液呈中性时,V(NaOH)<20mL |
| D、HA-的电离程度小于水解程度 |
根据如图实验装置判断,下列说法正确的是( )


| A、该装置能将电能转化为化学能 |
| B、活性炭为正极,其电极反应式为:2H++2e-═H2↑ |
| C、电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| D、装置内总反应方程式为:4Al+3O2+6H2O═4Al(OH)3 |
下列各对物质中属于同分异构体的是( )
| A、612C和613C |
| B、O2和O3 |
| C、(CH3)2CHCH2CH3和C(CH3)4 |
| D、H2C(CH3)2和CH3CH2 CH3 |
25℃时,将0.2mol KF固体溶于100mL 1mol?L-1 HBr溶液中,加水稀释得到1L溶液,若此溶液中c(F-)>c(Br-),下列判断不正确的是( )
| A、该溶液的pH小于7 |
| B、c(HF)+c(F-)=0.2 mol?L-1 |
| C、c(HF)<c(F-) |
| D、c(F-)+c(OH-)=0.1 mol?L-1 |
某化学兴趣小组学习原电池知识后,决定用其原理,尝试利用铁粉、活性炭、无机盐等物质开发产品.小组提出的设想或对原理的理解不正确的是( )
| A、打算制成小包装用于糕点的脱氧剂 |
| B、利用反应放出热量的原理制成暖宝宝 |
| C、调整电池结构,可降低温度,可用于延长糕点保质期 |
| D、正极的电极反应为:2H2O+O2+4e-=4OH- |

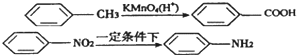
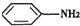 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)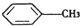 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.