题目内容
9.下列推论正确的是( )| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;△H1>△H2 | |
| B. | C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则可判定金刚石比石墨稳定 | |
| C. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测出的中和热数值偏小 | |
| D. | 已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol |
分析 A、固体硫燃烧时要先变为气态硫,过程吸热,据此确定反应热的大小;
B、物质的能量越高越不稳定;
C、铜质搅拌器代替环形玻璃搅拌棒,金属传热较快,使得热量散失更多,所测反应热热结果会偏低;
D、碳生成稳定的氧化物二氧化碳.
解答 解:A、固体硫燃烧时要先变为气态硫,过程吸热,气体与气体反应生成气体比固体和气体反应生成气体产生热量多,但反应热为负值,所以△H2>△H1,故A错误;
B、由热化学方程式可知,石墨总能量小于金刚石,则石墨较稳定,故B错误;
C、铜质搅拌器代替环形玻璃搅拌棒,金属传热较快,使得热量散失更多,所测反应热热结果会偏低,故C正确;
D、碳生成稳定的氧化物二氧化碳,而不是一氧化碳,所以不是碳的燃烧热,故D错误;
故选C.
点评 本题考查反应热及焓变,题目难度中等,本题注意把握热化学方程式的意义,把握比较反应热的方法.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
14.可以将五种无色液体:C2H5OH、AgNO3溶液、C2H5Br、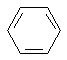 、KI溶液一一区分开的试剂是( )
、KI溶液一一区分开的试剂是( )
 、KI溶液一一区分开的试剂是( )
、KI溶液一一区分开的试剂是( )| A. | FeCl2溶液 | B. | NaOH溶液 | C. | 水 | D. | 溴水 |
15.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 元素W的氢化物的稳定性比X的氢化物稳定性强 | |
| B. | 元素Y的最高价氧化物对应水化物为强碱 | |
| C. | 化合物YX、ZX2、WX2中化学键类型相同 | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
4.在1L容器中含有2amolH2和2amolN2,设法使其反应并达到平衡,测得N2的转化率为20%,此时H2的浓度是( )
| A. | 0.4amol•L-1 | B. | 0.8amol•L-1 | C. | 1.6a mol•L-1 | D. | 1.8a mol•L-1 |
14.设NA表示阿伏加德罗常数的数值,下列有关说法正确的是( )
| A. | 标准状况下,22.4 L 氯水中含有的分子数为NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 1L 1mol•L-1的Na2CO3溶液中CO32-的数目为NA | |
| D. | 2.3 g金属钠与足量的氧气反应,无论加热与否转移电子数均为0.1NA |
1.下列变化,必须加入氧化剂才能发生的是( )
| A. | N2→NH3 | B. | HCl→H2 | C. | NO→NO2 | D. | Fe2O3→Fe |
18.被称为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,在其另一边镀二氧化锰)作为传导体.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为Zn+2MnO2+H2O═ZnO+2MnO(OH)下列说法不正确的是( )
| A. | 当该电池消耗1mol锌时,与CH4燃料电池消耗0.25molCH4产生电量相等 | |
| B. | 该电池二氧化锰为正极,发生氧化反应 | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- |