题目内容
19.标准状况下6.72L的H2和CO的混合气体质量为2.16g,则H2和CO的体积比为4:1,混合气体的平均相对分子质量为7.2,CO的质量分数为77.8%分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,再根据总质量、总物质的量列方程计算各自物质的量,相同条件下,气体的体积之比等于其物质的量之比,根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均相对分子质量,根据m=nM计算CO质量,进而计算CO的质量分数.
解答 解:混合气体总物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,
设H2和CO的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.3}\\{2x+28y=2.16}\end{array}\right.$
解得x=0.24,y=0.06
则H2和CO的体积比为0.24mol:0.06mol=4:1,
平均相对分子质量为$\frac{2.16}{0.3}$=7.2,
CO的质量为0.06mol×28g/mol=1.68g,CO的质量分数为$\frac{1.68g}{2.16g}$×100%=77.8%,
故答案为:4:1;7.2;77.8%.
点评 本题考查物质的量有关计算,比较基础,有利于基础知识的巩固,可以先计算平均相对分子质量,再利用十字相乘法计算体积之比.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列推论正确的是( )
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;△H1>△H2 | |
| B. | C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则可判定金刚石比石墨稳定 | |
| C. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测出的中和热数值偏小 | |
| D. | 已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol |
4.下列离子方程式书写正确的是( )
| A. | 铜跟硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 盐酸与澄清石灰水反应:H++OH-═H2O |
8.下列离子方程式与所述事实相符且正确的是( )
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸氢钙与少量澄清石灰水反应:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 强碱溶液中,次氯酸钠与Fe(OH)2:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ |
9.下列有关化学用语表示正确的是( )
| A. | 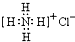 :可以表示氯化铵的电子式 :可以表示氯化铵的电子式 | |
| B. |  :可以表示中子数为18的氯原子结构示意图 :可以表示中子数为18的氯原子结构示意图 | |
| C. | 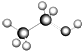 :可以表示乙醇分子的球棍模型 :可以表示乙醇分子的球棍模型 | |
| D. |  :既可以表示甲烷分子,也可以表示四氯化碳分子 :既可以表示甲烷分子,也可以表示四氯化碳分子 |
 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
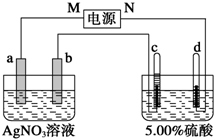 图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:
图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答: A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示: