题目内容
4.在1L容器中含有2amolH2和2amolN2,设法使其反应并达到平衡,测得N2的转化率为20%,此时H2的浓度是( )| A. | 0.4amol•L-1 | B. | 0.8amol•L-1 | C. | 1.6a mol•L-1 | D. | 1.8a mol•L-1 |
分析 测得N2的转化率为20%,氮气的消耗浓度=2a×20%=0.4amol/L,利用三段法计算出平衡时各物质的浓度,
N2 +3H2 =2NH3
起始量(mol/L) 2a 2a 0
变化量(mol/L) 0.4a 1.2a 0.8a
平衡量(mol/L) 2a-0.4a 2a-1.2a 0.8a
解答 解:利用三段法计算出平衡时各物质的浓度,测得N2的转化率为20%,氮气的消耗浓度=2a×20%=0.4amol/L,
N2 +3H2 =2NH3
起始量(mol/L) 2a 2a 0
变化量(mol/L) 0.4a 1.2a 0.8a
平衡量(mol/L) 2a-0.4a 2a-1.2a 0.8a
得到平衡状态下氢气的浓度为0.8amol/L,
故选B.
点评 本题考查了化学平衡的计算分析,三段式列式计算方法是解题关键,题目较简单.

练习册系列答案
相关题目
9.下列实验,温度计水银球不能放在液体中的是( )
| A. | 石油分馏实验 | B. | 乙醇脱水实验 | C. | 制溴苯 | D. | 苯的硝化实验 |
10.下列说法正确的是( )
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解时转移电子的物质的量为1 mol | |
| B. | 标准状况下,28 g CO、C2H4混合气体与22.4 L N2所含有的分子数都是NA | |
| C. | 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO3+2CO2 |
14.下例物质发生反应后固体质量一定减少的是( )
| A. | FeCO3在空气中灼烧 | B. | 铝条插入冷的浓硫酸中 | ||
| C. | Na2O2敞放在空气中 | D. | 向Mg(OH)2悬浊液中加入FeCl3溶液 |
9.下列推论正确的是( )
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;△H1>△H2 | |
| B. | C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则可判定金刚石比石墨稳定 | |
| C. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测出的中和热数值偏小 | |
| D. | 已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol |
16.在0.5L的密闭容器中,一定量的H2和N2进行如下化学反应:3H2(g)+N2(g)═2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表.请回答下列问题.
①比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃时,当测得NH3和N2、H2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(H2)正> V (H2)逆(填写“>”、“=”或“<”).
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②在400℃时,当测得NH3和N2、H2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(H2)正> V (H2)逆(填写“>”、“=”或“<”).
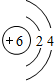 ;X元素基态原子的电子排布式为1s22s22p63s23p5.
;X元素基态原子的电子排布式为1s22s22p63s23p5.
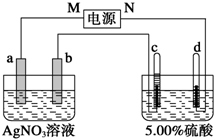 图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:
图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答: