题目内容
pH相同的等体积H2SO4、HF和CH3COOH三种溶液,分别滴加等浓度的NaOH溶液至恰好中和,消耗NaOH溶液的体积为V1、V2、V3,则三者的大小关系正确的是(已知Ka(HF)=6.8×10-4mol?L-1、Ka(CH3COOH)=1.7×10-5mol?L-1)( )
| A、V3>V2>V1 |
| B、V3=V2=V1 |
| C、V3>V2=V1 |
| D、V1=V2>V3 |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:pH相等的三种酸,说明这三种酸中氢离子浓度增大,氢氟酸和醋酸为弱电解质,溶液中存在电离平衡,且氢氟酸的电离平衡常数大于醋酸,则醋酸的浓度大于氢氟酸,分别和等浓度的氢氧化钠溶液反应至中性时,消耗氢氧化钠的体积与酸能完全电离出氢离子的物质的量成正比.
解答:
解:pH相等的三种酸,说明这三种酸中氢离子浓度增大,氢氟酸和醋酸为弱电解质,溶液中存在电离平衡,且氢氟酸的电离平衡常数大于醋酸,则醋酸的浓度大于氢氟酸,分别和等浓度的氢氧化钠溶液反应至中性时,消耗氢氧化钠的体积与酸能完全电离出氢离子的物质的量成正比,等pH和等体积的这三种酸能完全电离出氢离子浓度大小顺序是醋酸、氢氟酸和硫酸,则需要氢氧化钠溶液的体积为:V3>V2>V1,故选A.
点评:本题考查了弱电解质的电离,明确弱电解质的电离平衡常数与酸的酸性强弱关系是解本题关键,再结合物质之间的反应来分析解答,题目难度中等.

练习册系列答案
相关题目
下列化学式表示的一定是纯净物的是( )
| A、C3H8 |
| B、C12H22011 |
| C、C2H402 |
D、 |
下列电离或离子方程式正确的是( )
| A、亚硫酸的电离:H2SO3?2H++SO32- |
| B、氯化铵水解的离子方程式为:NH4++H2O?NH3?H2O+H+ |
| C、NaHCO3水解的离子方程式为:HCO3-+H2O?CO32-+H3O+ |
| D、向氯化铝溶液中加入过量的氨水:A13++3NH3?H2O=Al(OH)3↓+3NH4+ |
下列叙述中,正确的是( )
| A、金属与酸反应一定放出氢气 |
| B、含金属元素的离子一定是阳离子 |
| C、电离生成H+的化合物不一定是酸 |
| D、金属离子被还原一定得到金属单质 |
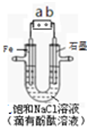 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )| A、a为电源的正极 |
| B、通电一段时间后,石墨电极附近溶液先变红 |
| C、Fe电极的电极反应是4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水的总反应是:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ |
下列说法正确的是( )
A、硝基苯的结构简式为 |
B、表示甲烷分子或四氯化碳分子的比例模型 |
| C、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 |
D、结构片段为 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |

 实验室用如图装置完成表中的四个实验,不能得到实验目的是( )
实验室用如图装置完成表中的四个实验,不能得到实验目的是( )