题目内容
18.某化合物A的分子式为C10H10O4,A不能与FeCl3溶液发生显色反应,在稀酸中加热能生成B、C、D三种化合物,化合物B能与FeCl3溶液发生显色反应,化合物C含碳的质量分数为40.0%,化合物D含氧的质量分数为50.0%.(1)写出化合物C、D的结构简式CH3COOH、CH3OH
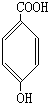
(2)写出化合物B的结构简式
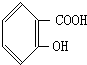 、
、 、
、
(3)写出化合物A的结构简式
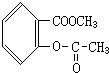 、
、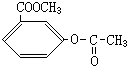 、
、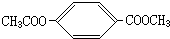 .
.
分析 化合物A的分子式为C10H10O4,A不能与FeCl3溶液发生显色反应,说明不含酚羟基,在稀酸中加热能生成B、C、D三种化合物,可知A含有两个酯基,化合物B能与FeCl3溶液发生显色反应,应含有酚羟基,化合物C含碳的质量分数为40.0%,化合物D含氧的质量分数为50.0%,如含有1个O,则相对分子质量为32,应为CH3OH,如含有2个O,则相对分子质量为64,没有符合题意的有机物,则化合物C应为酸,如化合物C含有2个C原子,则C的相对分子质量为$\frac{24}{0.4}$=60,为CH3COOH,符合题意,则B含有7个C原子,含有苯环、羧基和酚羟基,以此解答该题.
解答 解:化合物A的分子式为C10H10O4,A不能与FeCl3溶液发生显色反应,说明不含酚羟基,在稀酸中加热能生成B、C、D三种化合物,可知A含有两个酯基,化合物B能与FeCl3溶液发生显色反应,应含有酚羟基,化合物C含碳的质量分数为40.0%,化合物D含氧的质量分数为50.0%,如含有1个O,则相对分子质量为32,应为CH3OH,如含有2个O,则相对分子质量为64,没有符合题意的有机物,则化合物C应为酸,如化合物C含有2个C原子,则C的相对分子质量为$\frac{24}{0.4}$=60,为CH3COOH,符合题意,则B含有7个C原子,含有苯环、羧基和酚羟基,
(1)由以上分析可知C为CH3COOH,D为CH3OH,故答案为:CH3COOH、CH3OH;
(2)B含有7个C原子,含有苯环、羧基和酚羟基,可为 、
、 、
、 ,
,
故答案为: 、
、 、
、 ;
;
(3)由以上分析可知B为 、
、 、
、 ,C为乙酸,D为己醇,则A可能为,
,C为乙酸,D为己醇,则A可能为,
故答案为: 、
、 、
、 .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,正确判断B结构简式是解本题关键,注意把握有机物的结构与性质,把握相对分子质量的运用,难度不大.

 阅读快车系列答案
阅读快车系列答案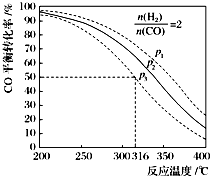 二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H,该反应△H=-263 kJ•mol-1,化学平衡常数K=K12•K2•K3(用含K1、K2、K3的代数式表示);
(3)下列措施中,能提高CH3OCH3产率的有AD;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率;
(5)以$\frac{n({H}_{2})}{n(CO)}$=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是CD;
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时$\frac{n(H2)}{n(CO)}$=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K=2.25.
| A. | 放电时负极得电子,质量减轻 | |
| B. | 放电时电解质溶液中的OH-向正极移动 | |
| C. | 充电时阴极附近溶液的pH减小 | |
| D. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入一定量的H2O(g) | |
| D. | 保持压强不变,充入N2使容器体积变大 |
| A. | 铜--电线 | B. | 铝--反射镜 | ||
| C. | 铁--回收溶液中的银 | D. | 不锈钢--炊具 |
| A. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| B. | 同周期主族元素离子半径从左到右依次减小 | |
| C. | HF、HCl、HBr、HI 的热稳定性依次减弱,还原性和水溶液的酸性依次增强 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| A. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-11.46 kJ•mol-1 | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-11.46 kJ•mol-1 | |
| C. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=+114.6 kJ•mol-1 | |
| D. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
 .
.
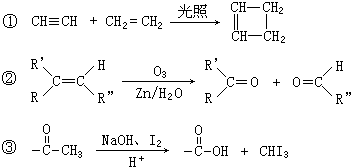
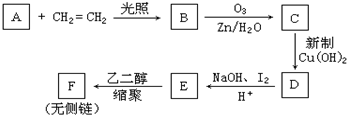
 ,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F
,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F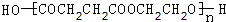 .
.