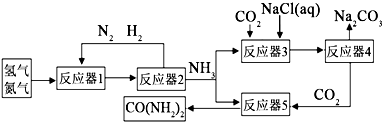
题目内容
某课外兴趣小组成员为研究金属铜与强酸的反应,将9.6克铜粉分为三等份,进行了如下一些实验,请完成有关计算.
(1)取其中一份与100mL一定浓度的硝酸反应,待固体完全溶解,产生的一氧化氮和二氧化氮混合气体在标准状况下的体积为0.896L.然后将剩余溶液稀释至1000mL,测得pH=0,请计算:生成的混合气体中一氧化氮的体积分数为 、反应前硝酸的物质的量浓度是
(2)再取另一份铜粉投入100mLpH=0的硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况).求反应前混合溶液中所含硫酸的物质的量是多少?(写出计算过程)
(3)用NaOH溶液吸收氮氧化物是防止NOx污染的一种方法.
原理为:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O
取最后一份铜粉溶于a mol/L过量的硝酸溶液30.0ml中,假设硝酸的还原产物只有一氧化氮和二氧化氮.待反应结束后,将所剩溶液加水稀释至1000m L,测得c(NO3-)=0.200mol/L.若反应所生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围.
(1)取其中一份与100mL一定浓度的硝酸反应,待固体完全溶解,产生的一氧化氮和二氧化氮混合气体在标准状况下的体积为0.896L.然后将剩余溶液稀释至1000mL,测得pH=0,请计算:生成的混合气体中一氧化氮的体积分数为
(2)再取另一份铜粉投入100mLpH=0的硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况).求反应前混合溶液中所含硫酸的物质的量是多少?(写出计算过程)
(3)用NaOH溶液吸收氮氧化物是防止NOx污染的一种方法.
原理为:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O
取最后一份铜粉溶于a mol/L过量的硝酸溶液30.0ml中,假设硝酸的还原产物只有一氧化氮和二氧化氮.待反应结束后,将所剩溶液加水稀释至1000m L,测得c(NO3-)=0.200mol/L.若反应所生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围.
考点:铜金属及其重要化合物的主要性质,有关范围讨论题的计算
专题:计算题
分析:n(Cu)=
=0.15mol,
(1)n(NOx)=
=0.04mol,剩余溶液中n(HNO3)=1mol/L×1L=1mol,设NO、NO2的物质的量分别为x、y,结合转移电子守恒得
,解得
,
相同条件下,不同气体的物质的量之比等于其体积之比,NO的体积分数等于其物质的量分数;
根据N原子守恒知,原来溶液中n(HNO3)=2[Cu(NO3)2]+n(NOx)+n(HNO3)(剩余)=2n(Cu)+n(NOx)+n(HNO3)(剩余)=0.15mol×
×2+0.04mol+1mol=1.14mol,
根据c=
计算硝酸物质的量浓度;
(2)n(NO)=
=0.02mol,原来混合溶液中pH=0的硫酸和硝酸混合溶液中c(H+)=1mol/L,
n(H+)=0.1L×1mol/L=0.1mol,n(Cu)=0.15mol×
=0.05mol,根据3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O可知,如果铜完全反应需要n(H+)=
≈0.13mol>0.1mol,铜过量,硝酸完全反应,所以n(HNO3)=n(NO)=0.02mol,
原来溶液中n(H+)=2n(H2SO4)+n(HNO3)=2n(H2SO4)+0.02mol=0.1mol,
据此计算硫酸的物质的量;
(3)设n(NO2)=xmol,n(NO)=ymol,
根据电子守恒,有x+3y=0.05×2,
根据N元素守恒,有x+y=0.03a-0.2,
解之得:x=(0.045a-0.35)mol,y=(0.15-0.015a)mol;
要使混合气体完全被NaOH吸收,则生成的二氧化氮和一氧化氮体积为≥1:1,采用极限法分析解答.
| 9.6g |
| 64g/mol |
(1)n(NOx)=
| 0.896L |
| 22.4L/mol |
|
|
相同条件下,不同气体的物质的量之比等于其体积之比,NO的体积分数等于其物质的量分数;
根据N原子守恒知,原来溶液中n(HNO3)=2[Cu(NO3)2]+n(NOx)+n(HNO3)(剩余)=2n(Cu)+n(NOx)+n(HNO3)(剩余)=0.15mol×
| 1 |
| 3 |
根据c=
| n |
| V |
(2)n(NO)=
| 0.448L |
| 22.4L/mol |
n(H+)=0.1L×1mol/L=0.1mol,n(Cu)=0.15mol×
| 1 |
| 3 |
| 0.05mol×8 |
| 3 |
原来溶液中n(H+)=2n(H2SO4)+n(HNO3)=2n(H2SO4)+0.02mol=0.1mol,
据此计算硫酸的物质的量;
(3)设n(NO2)=xmol,n(NO)=ymol,
根据电子守恒,有x+3y=0.05×2,
根据N元素守恒,有x+y=0.03a-0.2,
解之得:x=(0.045a-0.35)mol,y=(0.15-0.015a)mol;
要使混合气体完全被NaOH吸收,则生成的二氧化氮和一氧化氮体积为≥1:1,采用极限法分析解答.
解答:
解:n(Cu)=
=0.15mol,
(1)n(NOx)=
=0.04mol,剩余溶液中n(HNO3)=1mol/L×1L=1mol,设NO、NO2的物质的量分别为x、y,结合转移电子守恒得
解得
,
相同条件下,不同气体的物质的量之比等于其体积之比,NO的体积分数等于其物质的量分数=
×100%=75%;
根据N原子守恒知,原来溶液中n(HNO3)=2[Cu(NO3)2]+n(NOx)+n(HNO3)(剩余)=2n(Cu)+n(NOx)+n(HNO3)(剩余)=0.15mol×
×2+0.04mol+1mol=1.14mol,
原来硝酸物质的量浓度c=
=
=11.4mol/L,
故答案为:75%;11.4mol/L;
(2)n(NO)=
=0.02mol,原来混合溶液中pH=0的硫酸和硝酸混合溶液中c(H+)=1mol/L,
n(H+)=0.1L×1mol/L=0.1mol,n(Cu)=0.15mol×
=0.05mol,根据3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O可知,如果铜完全反应需要n(H+)=
≈0.13mol>0.1mol,铜过量,硝酸完全反应,所以n(HNO3)=n(NO)=0.02mol,
原来溶液中n(H+)=2n(H2SO4)+n(HNO3)=2n(H2SO4)+0.02mol=0.1mol,
n(H2SO4)=
=0.04mol,
答:反应前硫酸的物质的量是0.04mol;
(3)设n(NO2)=xmol,n(NO)=ymol,
根据电子守恒,有x+3y=0.05×2,
根据N元素守恒,有x+y=0.03a-0.2,
解之得:x=(0.045a-0.35)mol,y=(0.15-0.015a)mol;
如硝酸全部被还原为NO2,由转移电子数目相等可知生成的NO2物质的量为n(NO2)=2n(Cu)=2×0.05mol=0.1mol,则0.03a-0.2=0.1,a=10,
如生成NO和NO2,气体完全被吸收,则由反应2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O可知,应满足n(NO2)≥n(NO),
设二者物质的量相等,且都为xmol,则由转移电子数目相等可知x+3x=0.05×2,x=0.025,
此时0.03a-0.2=0.025×2,
a=
=8.3,
则a≥
,
应满足
≤a<10(或8.3≤a<10),
答:a的取值范围为
≤a<10(或8.3≤a<10).
| 9.6g |
| 64g/mol |
(1)n(NOx)=
| 0.896L |
| 22.4L/mol |
|
解得
|
相同条件下,不同气体的物质的量之比等于其体积之比,NO的体积分数等于其物质的量分数=
| 0.03mol |
| 0.03mol+0.01mol |
根据N原子守恒知,原来溶液中n(HNO3)=2[Cu(NO3)2]+n(NOx)+n(HNO3)(剩余)=2n(Cu)+n(NOx)+n(HNO3)(剩余)=0.15mol×
| 1 |
| 3 |
原来硝酸物质的量浓度c=
| n |
| V |
| 1.14mol |
| 0.1mol |
故答案为:75%;11.4mol/L;
(2)n(NO)=
| 0.448L |
| 22.4L/mol |
n(H+)=0.1L×1mol/L=0.1mol,n(Cu)=0.15mol×
| 1 |
| 3 |
| 0.05mol×8 |
| 3 |
原来溶液中n(H+)=2n(H2SO4)+n(HNO3)=2n(H2SO4)+0.02mol=0.1mol,
n(H2SO4)=
| 0.1mol-0.02mol |
| 2 |
答:反应前硫酸的物质的量是0.04mol;
(3)设n(NO2)=xmol,n(NO)=ymol,
根据电子守恒,有x+3y=0.05×2,
根据N元素守恒,有x+y=0.03a-0.2,
解之得:x=(0.045a-0.35)mol,y=(0.15-0.015a)mol;
如硝酸全部被还原为NO2,由转移电子数目相等可知生成的NO2物质的量为n(NO2)=2n(Cu)=2×0.05mol=0.1mol,则0.03a-0.2=0.1,a=10,
如生成NO和NO2,气体完全被吸收,则由反应2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O可知,应满足n(NO2)≥n(NO),
设二者物质的量相等,且都为xmol,则由转移电子数目相等可知x+3x=0.05×2,x=0.025,
此时0.03a-0.2=0.025×2,
a=
| 25 |
| 3 |
则a≥
| 25 |
| 3 |
应满足
| 25 |
| 3 |
答:a的取值范围为
| 25 |
| 3 |
点评:本题以硝酸和铜为载体考查方程式的有关计算,侧重考查分析、计算能力,注意利用原子守恒、转移电子守恒进行解答,难点是a取值范围的计算,题目难度中等.

练习册系列答案
相关题目
下面关于电解质的叙述中正确的是( )
| A、液态硫酸不导电,硫酸是非电解质 |
| B、NaHSO4在熔融状态下电离产生Na+和HSO4-两种离子 |
| C、溶于水后能导电的化合物一定是电解质 |
| D、电解质在电流的作用下电离产生离子 |
用已知浓度的NaOH溶液滴定未知浓度的醋酸,下列情况,测得结果偏高的是( )
①用酚酞作指示剂
②滴定管用水洗后,未用标准溶液润洗就装入标准溶液
③锥形瓶盛待测液前,未用待测液润洗
④标准液读数时,滴定前仰视,滴定后俯视
⑤用于取待测液的滴定管未用待测液润洗
⑥在摇动锥形瓶的过程中不慎溅出了一小部分溶液
⑦滴定达终点时发现滴定管尖嘴处挂着一滴液滴.
①用酚酞作指示剂
②滴定管用水洗后,未用标准溶液润洗就装入标准溶液
③锥形瓶盛待测液前,未用待测液润洗
④标准液读数时,滴定前仰视,滴定后俯视
⑤用于取待测液的滴定管未用待测液润洗
⑥在摇动锥形瓶的过程中不慎溅出了一小部分溶液
⑦滴定达终点时发现滴定管尖嘴处挂着一滴液滴.
| A、①③④ | B、②③ |
| C、②⑦ | D、④⑤⑥ |
关于三种有机物叙述错误的是(-SH的性质类似于-OH)( )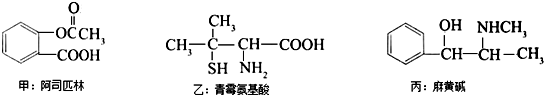
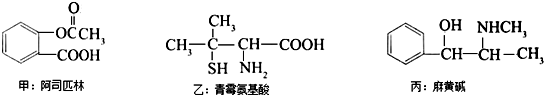
| A、都能发生酯化反应 |
| B、都能与NaOH反应 |
| C、甲的苯环上的一氯代物有4种 |
| D、丙的分子式为C10H15ON,苯环上的一氯代物有3种 |
化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A、为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰 |
| B、小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| C、节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| D、青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |