题目内容
为了实现资源利用最大化,某化工厂将合成氨、制纯碱和生产尿素(CO(NH2))工艺联合,简易流程如下:
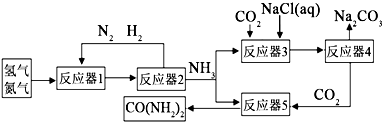
(1)25℃时101kPa时,测得生成17g NH3,放出46.2kJ热量,写出合成NH3的热化学方程式 .
(2)合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 .
(3)反应器2分离出来的氮气和氢气再通入反应器1,其目的是 .向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得NaHCO3.反应器3中的化学方程式为 .
(4)工业上可用碳、甲烷与水蒸汽反应制氢气
①C+H2O(g)?CO+H2,△H>0,此反应的化学平衡常数表达式为K= ,为了提高碳的转化率,宜采用下列措施中的(填字母编号) .
A.增大压强 B.增加碳的量 C.升高温度D.增加水的量 E.使用催化剂 F.及时移出CO、H2
②有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 .
③若仅以CH4、空气、H2O为原料制尿素(CH4+2H2O(g)
CO2+4H2),标准状况下22.4m3 CH4,理论上最多能制 ㎏尿素.

(1)25℃时101kPa时,测得生成17g NH3,放出46.2kJ热量,写出合成NH3的热化学方程式
(2)合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为
(3)反应器2分离出来的氮气和氢气再通入反应器1,其目的是
(4)工业上可用碳、甲烷与水蒸汽反应制氢气
①C+H2O(g)?CO+H2,△H>0,此反应的化学平衡常数表达式为K=
A.增大压强 B.增加碳的量 C.升高温度D.增加水的量 E.使用催化剂 F.及时移出CO、H2
②有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为
③若仅以CH4、空气、H2O为原料制尿素(CH4+2H2O(g)
| ||
| 加热 |
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:
分析:(1)N2和H2完全反应生成17g即1molNH3放热46.2kJ热量,生成2mol氨气放热92.4KJ,反应为放热反应,反应的焓变为-92.4KJ/mol,依据热化学方程式书写得到;
(2)硫化氢与氨水反应生成NH4HS;
(3)氮气和氢气再通入反应器1可节约燃料;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵;
(4)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;为提高某一反应物的转化率,应使平衡向正反应反应方向移动;
②电解硫酸钠溶液实质是电解水;
③由C原子守恒可知,CH4~CO2~CO(NH2)2,以此计算.
(2)硫化氢与氨水反应生成NH4HS;
(3)氮气和氢气再通入反应器1可节约燃料;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵;
(4)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;为提高某一反应物的转化率,应使平衡向正反应反应方向移动;
②电解硫酸钠溶液实质是电解水;
③由C原子守恒可知,CH4~CO2~CO(NH2)2,以此计算.
解答:
解:(1)N2和H2完全反应生成17g即1molNH3放热46.2kJ热量,生成2mol氨气放热92.4KJ,反应为放热反应,反应的焓变为-92.4KJ/mol,反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4KJ/mol;
故答案为:N2(g)+H2(g)═2NH3(g)△H═-92.4kJ/mol;
(2)硫化氢与氨水反应生成NH4HS,故答案为:NH4HS;
(3)氮气和氢气再通入反应器1可节约燃料,提高原料利用率;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵:NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl,
故答案为:提高原料利用率;NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl;
(4)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积积,所以K=
;为提高碳的转化率,应是反应向正反应方向移动,则可采取的措施有:升高温度、增加水的量、及时分离出CO、H2,
故答案为:
;CDF;
②电解硫酸钠溶液实质是电解水,阳极反应式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
③22.4m3 CH4的物质的量是1000mol,由C原子守恒可知,CH4~CO2~CO(NH2)2,CO(NH2)2的物质的量是1000mol,质量60000g,即60kg,故答案为:60.
故答案为:N2(g)+H2(g)═2NH3(g)△H═-92.4kJ/mol;
(2)硫化氢与氨水反应生成NH4HS,故答案为:NH4HS;
(3)氮气和氢气再通入反应器1可节约燃料,提高原料利用率;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵:NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl,
故答案为:提高原料利用率;NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl;
(4)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积积,所以K=
| c(CO)×c(H2) |
| c(H2O) |
故答案为:
| c(CO)×c(H2) |
| c(H2O) |
②电解硫酸钠溶液实质是电解水,阳极反应式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
③22.4m3 CH4的物质的量是1000mol,由C原子守恒可知,CH4~CO2~CO(NH2)2,CO(NH2)2的物质的量是1000mol,质量60000g,即60kg,故答案为:60.
点评:本题考查制备实验方案的设计,涉及热化学方程式的书写、化学平衡以及化学计算等知识,难度中等,(4)为学生解答的难点和易错点.

练习册系列答案
相关题目
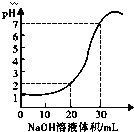 如图为10mL x mol?L-1的盐酸用y mol?L-1的NaOH溶液滴定的图象,依据图象推出x和y的数值可能是下列各组中的( )
如图为10mL x mol?L-1的盐酸用y mol?L-1的NaOH溶液滴定的图象,依据图象推出x和y的数值可能是下列各组中的( )| A | B | C | D | |
| x | 0.12 | 0.04 | 0.03 | 0.09 |
| y | 0.04 | 0.12 | 0.09 | 0.03 |
| A、A | B、B | C、C | D、D |
关于
C的说法正确的是( )
| 12 |
| 6 |
| A、质量数为6 |
| B、质子数为6 |
| C、电子数为13 |
| D、中子数为6 |
硫酸的下列性质与对应解释正确的是( )
| A、能与金属铜反应一强酸性 |
| B、能使蔗糖变黑-吸水性 |
| C、能和木炭反应-强氧化性 |
| D、能作干燥剂-脱水性 |
能再溶液中大量共存的一组离子是( )
| A、Na+、Ba2+、OH-、NO3- |
| B、Al3+、NH4+、OH-、Cl- |
| C、K+、Na+、ClO-、SO32- |
| D、H+、Na+、AlO2-、Cl- |


 的邻位异构体分子内脱水产物,香豆素的结构简式为
的邻位异构体分子内脱水产物,香豆素的结构简式为