题目内容
6.两个化学兴趣小组进行了以下探究活动:第一组:为研究铁质材料与热浓硫酸的反应
(l)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y,
①检验溶液X中含有SO42-的试剂是HCl、BaCl2
②乙同学取896ml(标准状况)气体Y 通入足量溴水中,充分反应后,再滴加足量BaCl2溶液,经适当操作后得到干燥固体4.66g.据此推知气体Y中据此推知气体Y 中SO2的体积分数为50%.分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有还可能含有H2和CO2气体.
为此设计了如图1探究实验装置(图中夹持仪器省略).
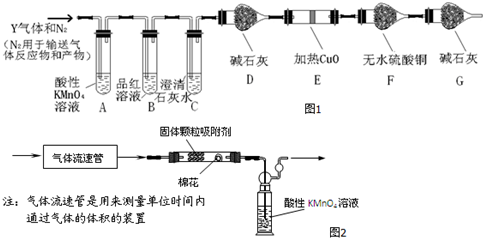
(2)写出产生CO2的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(3)装置F的作用检验是否有水蒸气产生
(4)简述气体Y中含有CO2的实验现象是B中品红不褪色,C中澄清石灰水变浑浊
第二组:拟用如图2装置定量分析空气中SO2的含量:
(5)实验需要配制KMnO4溶液,下列操作会引起所配溶液浓度偏大的是B(填写字母),
A.容量瓶用蒸馏水洗涤后未干燥即用来配制溶液
B.定容时,观察液面俯视刻度线
C.摇匀后,液面低于刻度线,没有再加蒸馏水
D.用蒸馏水洗涤烧杯和玻璃棒.并将洗涤液转移入容量瓶中
(6)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L.若从气体通入到紫色恰好褪去,用时5分钟.则此次取样处的空气中二氧化硫含量为$\frac{32bc}{a}$g/L.
分析 (1)碳素钢放入浓硫酸中,在加热时发生反应:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,随着反应的进行,当酸溶液变稀后会发生反应:Fe+H2SO4=FeSO4+H2↑.反应后得到的溶液X中含有硫酸铁、及过量的硫酸,气体Y中含有SO2、CO2和水蒸气.
①先加盐酸排除干扰离子,再加氯化钡检验硫酸根离子;
②将气体Y 通入足量溴水中,充分反应后,再滴加足量BaCl2溶液,经适当操作后得到干燥固体4.66g.则n(SO2)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,气体的总物质的量是n=$\frac{0.896L}{22.4L/mol}$=0.04mol,以此计算体积分数;
(2)C与浓硫酸在加热时反应生成二氧化硫、水、CO2;
(3)装置F中盛有无水硫酸铜,遇水变为蓝色;
(4)B中品红不褪色说明SO2已经被除尽,而C中澄清石灰水变浑浊,可证明含有CO2气体;
(5)A.容量瓶用蒸馏水洗涤后未干燥即用来配制溶液,由于不影响溶质的物质的量和溶液的体积;
B.定容时,观察液面俯视刻度线,则溶液的体积偏小;
C.摇匀后,液面低于刻度线,没有再加蒸馏水,操作合理;
D.用蒸馏水洗涤烧杯和玻璃棒,并将洗涤液转移入容量瓶中,操作正确;
(6)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L.若从气体通入到紫色恰好褪去,用时5分钟,则气体的体积是V=5aL,根据SO2与KMnO4反应的方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4可知n(SO2)=$\frac{5}{2}$n(KMnO4)=2.5bcmol,以此计算此次取样处的空气中二氧化硫含量.
解答 解:(1)碳素钢放入浓硫酸中,在加热时发生反应:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,随着反应的进行,当酸溶液变稀后会发生反应:Fe+H2SO4=FeSO4+H2↑.反应后得到的溶液X中含有硫酸铁、及过量的硫酸,气体Y中含有SO2、CO2和水蒸气.
①检验溶液X中含有SO42-的方法是取少量该溶液,向其中加入稀盐酸,无现象,然后加入BaCl2溶液,产生白色沉淀,因此加入的试剂是HCl、BaCl2,
故答案为:HCl、BaCl2;
②将气体Y 通入足量溴水中,充分反应后,再滴加足量BaCl2溶液,经适当操作后得到干燥固体4.66g.n(SO2)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,气体的总物质的量是n=$\frac{0.896L}{22.4L/mol}$=0.04mol,所以其中SO2的含量是$\frac{0.02mol}{0.04mol}$×100%=50%,故答案为:50%;
(2)C与浓硫酸在加热时反应产生CO2的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)装置F中盛有无水硫酸铜,其作用是检验是否产生了水蒸气,故答案为:检验是否有水蒸气产生;
(4)气体Y中含有CO2的实验现象是B中品红不褪色说明SO2已经被除尽,而C中澄清石灰水变浑浊,证明含有CO2气体,
故答案为:B中品红不褪色,C中澄清石灰水变浑浊;
(5)A.容量瓶用蒸馏水洗涤后未干燥即用来配制溶液,由于不影响溶质的物质的量和溶液的体积,所以对配制的溶液的浓度不产生任何影响,故不选;
B.定容时,观察液面俯视刻度线,则溶液的体积偏小,导致配制的溶液的浓度偏大,故选;
C.摇匀后,液面低于刻度线,没有再加蒸馏水,则不会对溶液的浓度产生误差,故不选;
D.用蒸馏水洗涤烧杯和玻璃棒,并将洗涤液转移入容量瓶中,操作正确无误,故不选;
故答案为:B;
(6)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L.若从气体通入到紫色恰好褪去,用时5分钟,则气体的体积是V=5aL,根据SO2与KMnO4反应的方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4可知n(SO2)=$\frac{5}{2}$n(KMnO4)=2.5bcmol,则此次取样处的空气中二氧化硫含量为$\frac{2.5bcmol×64g/mol}{5aL}$=$\frac{32bc}{a}$g/L,故答案为:$\frac{32bc}{a}$.
点评 本题考查物质的性质实验及制备实验,为高频考点,把握化学实验基本操作、铁质材料与热浓硫酸的反应的实验方案的设计、离子的检验方法、物质成分的确定及混合物中组成成分的含量的计算的知识为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

| 实验 | 检验方法 | |
| A | 向沸水中滴加饱和FeCl3溶液,制备胶体 | 用可见光束照射 |
| B | 确认铜与浓硫酸反应生成CuSO4 | 将反应后溶液转入盛有水的烧杯中 |
| C | 区分AgNO3溶液和Al2(SO4)3溶液 | 分别取少量溶液,滴加BaCl2溶液 |
| D | 证明氯水中起漂白作用的不是Cl2 | 用CCl4充分萃取,将红纸条分别浸入分层后的溶液中 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 上述三个反应都有单质生成.都属于置换反应 | |
| B. | 氧化性KClO>Br,还原性Br->CI- | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中2mol还原剂反应则氧化剂得到电子的物质的量为2mol |
| A. | 60% | B. | 77.8% | C. | 48.0% | D. | 34.4% |
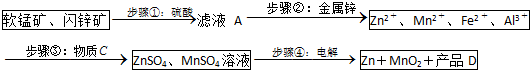
已知各种金属离子完全沉淀的pH如表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是溶解软锰矿、闪锌矿,可以循环利用.
| A. | NaCl | B. | NH4Cl | C. | Na2CO3 | D. | NaOH |
| A. | 1molFeI2与1molCl2反应时转移的电子数为3NA | |
| B. | 2g H218O与D216O的混合物中所含中子、电子数目均为NA | |
| C. | 273K,101kPa下,28g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | pH=1的H2SO4溶液10L,含H+的数目为2NA |
| A. | 标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为NA/11.2 | |
| B. | 将lmol Cl2通人水中,HClO、Cl一、ClO-粒子数之和为2NA | |
| C. | 含3.0g HCHO的水溶液中原子总数为0.4 NA | |
| D. | 3.4gNH3中共用电子对数为0.6NA |