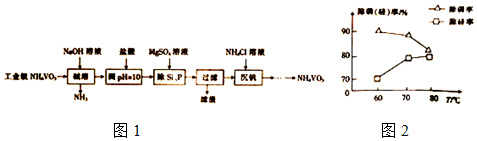
题目内容
14.下列过程放出热量的是( )| A. | 液氨气化 | B. | 钠与水反应 | C. | 碳酸钙分解 | D. | 化学键的断裂 |
分析 放出热量的过程可以是放热反应,也可以是放热的物理过程;
常见的放热反应有:绝大多数的化合反应、所有的燃烧、金属和水或酸的反应、酸碱中和反应、铝热反应;
常见的放热的物理过程有:浓硫酸用水稀释;氢氧化钠固体溶于水;物质由气态→液态→固态,据此进行分析.
解答 解:A.液态物质具有能量小于气态,则液氨气化吸收热量,故A错误;
B.钠与水反应生成氢氧化钠和氢气,该反应为放热反应,故B正确;
C.碳酸钙在高温下分解生成氧化钙和二氧化碳,该反应为吸热反应,故C错误;
D.化学键旧键断裂需要吸收热量,故D错误;
故选B.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确常见化学反应与能量变化的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
4.(1)在25℃时,HSCN、HClO、H2CO3的电离常数如表:
①1mol•L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为c(K+)>c(SCN-)>c(OH-)>c(H+).
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为Na2CO3+HClO=NaHCO3+NaClO.
③25℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案.下列三种方案中,你认为能够达到实验目的是ac(填字母).
a.用pH计测量0.1mol•L-1NaClO溶液的pH,若所得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01mol•L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1mol•L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
(2)①肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.联氨溶于水可以发生与氨水类似的电离.试写出联氨在水溶液中的电离方程式N2H4+H2O?N2H5++OH-(写一步即可).
②NH4+在溶液中能发生水解反应.在25℃时,0.1mol•L-1的氯化铵溶液由水电离出的氢离子浓度为1×10-5mol•L-1,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3•H2O)=1×10-5.
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | K1=4.3×10-7 K2=5.6×10-11 |
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为Na2CO3+HClO=NaHCO3+NaClO.
③25℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案.下列三种方案中,你认为能够达到实验目的是ac(填字母).
a.用pH计测量0.1mol•L-1NaClO溶液的pH,若所得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01mol•L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1mol•L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
(2)①肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.联氨溶于水可以发生与氨水类似的电离.试写出联氨在水溶液中的电离方程式N2H4+H2O?N2H5++OH-(写一步即可).
②NH4+在溶液中能发生水解反应.在25℃时,0.1mol•L-1的氯化铵溶液由水电离出的氢离子浓度为1×10-5mol•L-1,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3•H2O)=1×10-5.
9.漂白粉的主要成分是CaCl2和( )
| A. | Ca(ClO3)2 | B. | Ca(ClO)2 | C. | NaClO | D. | NaHCO3 |
19.下列关于有机物的说法正确的是( )
| A. | 苯分子中无碳碳双键,苯不能发生加成反应 | |
| B. | 甲烷能与氯水发生取代反应 | |
| C. | 乙醇在一定条件下能被氧化成乙醛 | |
| D. | 乙烯和苯均能与溴水反应而使其褪色 |
3.某太阳能电池的工作原理如图所示.下列说法不正确的是( )
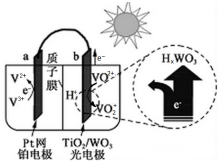

| A. | 光照时,太阳能主要转化为电能 | |
| B. | 光照时,b极的电极反应式为VO2+-e-+H2O═VO2++2H+ | |
| C. | 光照时,每转移5 mol电子,有5mol H+由b极区向a极区迁移 | |
| D. | 夜间,a极的电极反应式为V3++e-═V2+ |
4.化学是你,化学是我,化学深入我们生活,下列说法正确的是( )
| A. | 苯甲酸和苯甲酸钠都是食品防腐剂 | |
| B. | 食用花生油和汽油都属于酯 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 毛发、鸡蛋清都不能发生水解反应 |
 乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.
 +HCl
+HCl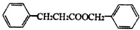 ;检验M中官能团的试剂是银氨溶液或新制备氢氧化铜浊液.
;检验M中官能团的试剂是银氨溶液或新制备氢氧化铜浊液.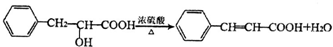 ,
, .
.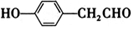 .
.