题目内容
4.(1)在25℃时,HSCN、HClO、H2CO3的电离常数如表:| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | K1=4.3×10-7 K2=5.6×10-11 |
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为Na2CO3+HClO=NaHCO3+NaClO.
③25℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案.下列三种方案中,你认为能够达到实验目的是ac(填字母).
a.用pH计测量0.1mol•L-1NaClO溶液的pH,若所得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01mol•L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1mol•L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
(2)①肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.联氨溶于水可以发生与氨水类似的电离.试写出联氨在水溶液中的电离方程式N2H4+H2O?N2H5++OH-(写一步即可).
②NH4+在溶液中能发生水解反应.在25℃时,0.1mol•L-1的氯化铵溶液由水电离出的氢离子浓度为1×10-5mol•L-1,则在该温度下此溶液中氨水的电离平衡常数Kb(NH3•H2O)=1×10-5.
分析 (1)①KSCN溶液中SCN-水解显碱性;
②分析电离平衡常数可知HSCN>H2CO3>HClO;碳酸钠和次氯酸反应生成碳酸氢钠和次氯酸钠;
③证明弱酸应设计实验证明溶液中存在电离平衡;
(2)①类比氨水的电离,写出肼在水溶液中的电离方程式;
②写出氨水电离方程式,计算出离子浓度,代入电离平衡常数表达式计算氨水的电离平衡常数.
解答 解:(1)①KSCN溶液中SCN-水解显碱性,溶液中离子浓度大小为c(K+)>c(SCN-)>c(OH-)>c(H+),
故答案为:c(K+)>c(SCN-)>c(OH-)>c(H+);
②分析电离平衡常数可知HSCN>H2CO3>HClO;碳酸钠和次氯酸反应生成碳酸氢钠和次氯酸钠,反应的化学方程式为:Na2CO3+HClO=NaHCO3+NaClO,
故答案为:Na2CO3+HClO=NaHCO3+NaClO;
③证明弱酸应设计实验证明溶液中存在电离平衡;
a.用pH计测量0.1mol•L-1 NaClO溶液的pH,若测得pH>7,说明次氯酸根离子水解,可证明HClO为弱酸,故a正确;
b.用pH试纸测量0.01mol•L-1 HClO溶液的pH,由于次氯酸具有漂白性,PH试纸不能测定溶液PH,不能证明HClO为弱酸,故b错误;
c、用仪器测量浓度均为0.1mol•L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,说明次氯酸溶液中离子浓度小于盐酸,存在电离平衡,可证明HClO为弱酸,故c正确;
故答案为:ac;
(2)①肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O=N2H5++OH-;
故答案为:N2H4+H2O=N2H5++OH-;
②NH4+在溶液中能发生水解反应,NH4++H2O?NH3•H2O+H+
故c(NH3•H2O)=c(H+)=1×10-5mol/L,则c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,c(NH4+)=0.1mol/L,
氨水的电离方程式为:NH3•H2O?NH4++OH-
电离平衡常数Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,
把以上数据代入平衡常数表达式:Kb(NH3•H2O)=$\frac{0.1mol/L×1{0}^{-9}mol/L}{1{0}^{-5}mol/L}$=1×10-5mol/L,
故答案为:1×10-5mol/L.
点评 本题考查了盐类水解和弱电解质电离程度分析判断,掌握基础是关键,电离方程式的书写及电离平衡常数的计算,其中电离平衡常数计算较难,应根据电离平衡表达式,计算出相应离子浓度代入表达式即可,注意次氯酸的漂白性,题目难度中等.

| A. | 加热前称量时坩埚未完全干燥 | B. | 加热时间过长,晶体部分变黑 | ||
| C. | 加热过程中有少量晶体溅出 | D. | 在空气中冷却 |
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═A1O2-+2H2↑ | |
| B. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- | |
| C. | 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:2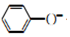 +CO2+H2O→2 +CO2+H2O→2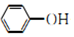 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ |
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S (g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3④2S(g)═S2(g)△H4
则△H4的正确表达式为( )
| A. | △H4=(△H1+△H2-3△H3)×$\frac{1}{3}$ | B. | △H4=(3△H3-△H1-△H2)×$\frac{2}{3}$ | ||
| C. | △H4=(△H1+△H2-3△H3)×$\frac{2}{3}$ | D. | △H4=(△H1-△H2-3△H3)×$\frac{3}{2}$ |
| A. | KOH | B. | H2SO3 | C. | KCl | D. | NaNO3 |
| A. | 常温常压下,等质量的N2和CO气休的原子数均为2NA | |
| B. | 在反应KC1O4+8HCI=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA | |
| C. | 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA | |
| D. | 标准状况下,80gSO3中含3NA个氧原子,体积约为22.4L |
| A. | 液氨气化 | B. | 钠与水反应 | C. | 碳酸钙分解 | D. | 化学键的断裂 |
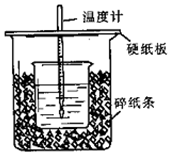 50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50 mL 0.50 mol•L-1盐酸与50 mL 0.55 mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: