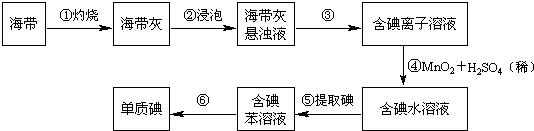
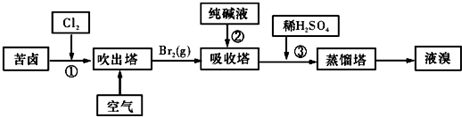
题目内容
已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色.取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下.
①滴加适量的NaBiO3溶液,溶液变为紫红色.
②继续滴加适量H2O2,紫红色褪去,并有气泡产生.
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色.
④最后通入足量的SO2气体,请回答下列问题:
(a)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(b)实验④中的现象为: ;
(c)实验②反应的离子方程式是: .
①滴加适量的NaBiO3溶液,溶液变为紫红色.
②继续滴加适量H2O2,紫红色褪去,并有气泡产生.
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色.
④最后通入足量的SO2气体,请回答下列问题:
(a)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为
(b)实验④中的现象为:
(c)实验②反应的离子方程式是:
考点:氧化性、还原性强弱的比较,离子方程式的书写
专题:
分析:取一定量的Mn(NO3)2溶液依次进行下列实验,①滴加适量的NaBiO3溶液,溶液变为紫红色,说明Mn2+被氧化生成MnO4-;
②继续滴加适量H2O2,紫红色褪去,并有气泡产生,说明双氧水被MnO4-氧化生成氧气;
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色,说明Mn2+被氧化生成MnO4-;
④最后通入足量的SO2气体,二氧化硫具有还原性,能被MnO4-氧化生成硫酸根离子,
(a)自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(b)二氧化硫具有还原性,高锰酸根离子具有强氧化性,二者发生氧化还原反应;
(c)实验②中双氧水被氧化生成氧气和、高锰酸根离子被还原生成锰离子.
②继续滴加适量H2O2,紫红色褪去,并有气泡产生,说明双氧水被MnO4-氧化生成氧气;
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色,说明Mn2+被氧化生成MnO4-;
④最后通入足量的SO2气体,二氧化硫具有还原性,能被MnO4-氧化生成硫酸根离子,
(a)自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(b)二氧化硫具有还原性,高锰酸根离子具有强氧化性,二者发生氧化还原反应;
(c)实验②中双氧水被氧化生成氧气和、高锰酸根离子被还原生成锰离子.
解答:
解:取一定量的Mn(NO3)2溶液依次进行下列实验,①滴加适量的NaBiO3溶液,溶液变为紫红色,说明Mn2+被氧化生成MnO4-;
②继续滴加适量H2O2,紫红色褪去,并有气泡产生,说明双氧水被MnO4-氧化生成氧气;
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色,说明Mn2+被氧化生成MnO4-;
④最后通入足量的SO2气体,二氧化硫具有还原性,能被MnO4-氧化生成硫酸根离子,
(a)通过以上分析知,氧化性强弱顺序是PbO2>KMnO4>H2O2,故答案为:PbO2>KMnO4>H2O2;
(b)④中KMnO4氧化SO2气体生成SO42-,自身被还原为Mn2+,SO42-和③中生成的Pb2+反应生成白色沉淀.
故答案为:溶液紫红色褪去,有白色沉淀生成;
(c)实验②中双氧水被氧化生成氧气和、高锰酸根离子被还原生成锰离子,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.
②继续滴加适量H2O2,紫红色褪去,并有气泡产生,说明双氧水被MnO4-氧化生成氧气;
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色,说明Mn2+被氧化生成MnO4-;
④最后通入足量的SO2气体,二氧化硫具有还原性,能被MnO4-氧化生成硫酸根离子,
(a)通过以上分析知,氧化性强弱顺序是PbO2>KMnO4>H2O2,故答案为:PbO2>KMnO4>H2O2;
(b)④中KMnO4氧化SO2气体生成SO42-,自身被还原为Mn2+,SO42-和③中生成的Pb2+反应生成白色沉淀.
故答案为:溶液紫红色褪去,有白色沉淀生成;
(c)实验②中双氧水被氧化生成氧气和、高锰酸根离子被还原生成锰离子,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.
点评:本题考查氧化性强弱比较,侧重考查学生分析问题、解答问题能力,会根据实验现象确定发生的反应,从而确定物质的性质,知道氧化性强弱、还原性强弱比较方法,知道常见元素化合价,题目难度中等.

练习册系列答案
相关题目
心酮胺是治疗冠心病的药物.它具有如下结构简式:下列关于心酮胺的描述,错误的是( )
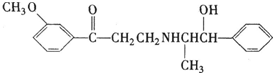
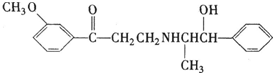
| A、可以在催化剂作用下和溴反应 |
| B、可以在碱性条件下发生水解反应 |
| C、能够使酸性高锰酸钾溶液褪色 |
| D、可以和浓硫酸与浓硝酸的混合液反应 |
下列反应的离子方程式不正确的是( )
A、石英与烧碱溶液共热:SiO2+2OH-
| ||||
| B、在氯化铝溶液中滴加过量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ | ||||
| C、在氢氧化钠溶液中通入少量CO2:2OH-+CO2═CO32-+H2O | ||||
| D、用NaOH液溶解Al2O3:Al2O3+6OH-═2[Al(OH)4]-+H2O |