题目内容
14.下列方程式正确的是( )| A. | Ba(OH)2═Ba2++2OH- | B. | NaHSO4═Na++HSO4? | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |
分析 A.氢氧化钡为强电解质完全电离;
B.硫酸氢钠为强电解质,在水溶液中完全电离;
C.碳酸根离子为多元弱酸根离子,分步水解,以第一步为主;
D.三价铁离子水解生成氢氧化铁和水,水解产生氢氧化铁少量,不标注沉淀符号.
解答 解:A.氢氧化钡为强电解质完全电离,电离方程式:Ba(OH)2=Ba2++2OH-,故A正确;
B.硫酸氢钠为强电解质,在水溶液中完全电离,电离方程式:NaHSO4=Na++H++SO42-,故B错误;
C.碳酸根离子水解方程式:CO32-+H2O?HCO3-+OH-,故C错误;
D.三价铁离子水解离子方程式:Fe3++3H2O?Fe(OH)3+3H+,故D错误;
故选:A.
点评 本题考查了电解质电离方程式、盐类水解离子方程式的书写,明确电解质强弱及电离方式,熟悉盐类水解规律是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.若 是某烃(分子式为C10H20)与H2加成后的产物,则该烃的结构可能有( )
是某烃(分子式为C10H20)与H2加成后的产物,则该烃的结构可能有( )
 是某烃(分子式为C10H20)与H2加成后的产物,则该烃的结构可能有( )
是某烃(分子式为C10H20)与H2加成后的产物,则该烃的结构可能有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2. 现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞溶液作指示剂.
(3)读取盛装0.100 0mol/L NaOH溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.70mL.
(4)滴定.滴定终点的现象是溶液由无色恰好变为浅红色,并在半分钟内不褪色.
Ⅱ.数据记录:
Ⅲ.数据处理:
某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4mL=15.24mL.
(5)指出他的计算的不合理之处:第一组数据与后三组数据相差较大,属于异常值,应舍去;按正确数据处理,可得市售白醋总酸量=4.500g/100mL.(结果保留四位有效数字)
 现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).Ⅰ.实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞溶液作指示剂.
(3)读取盛装0.100 0mol/L NaOH溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.70mL.
(4)滴定.滴定终点的现象是溶液由无色恰好变为浅红色,并在半分钟内不褪色.
Ⅱ.数据记录:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4mL=15.24mL.
(5)指出他的计算的不合理之处:第一组数据与后三组数据相差较大,属于异常值,应舍去;按正确数据处理,可得市售白醋总酸量=4.500g/100mL.(结果保留四位有效数字)
9.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | 每生成1mol Na2Mn5O10转移2mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 若用阳离子交换膜,当电路中转移0.2mole-,负极区将减少0.4mol离子 |
19.同一主族元素原子序数的差值不可能是( )
| A. | 10、16、32 | B. | 8、18、28 | C. | 16、26、36 | D. | 34、44、54 |
6.既能溶于盐酸,又能溶于NaOH溶液的是( )
| A. | Si | B. | Mg | C. | MgO | D. | Al2O3 |
3.在相同条件下完全燃烧甲烷、丙烷、乙烯.如使产生的水蒸气(相同状况)的体积相等,则所需三种气体的质量比是( )
| A. | 1:2:1 | B. | 2:1:2 | C. | 4:22:7 | D. | 8:11:14 |
4.单斜硫和正交硫是硫的两种同素异形体.
已知:①S(s,单斜)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(s,正交)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
下列说法正确的是( )
已知:①S(s,单斜)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(s,正交)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
下列说法正确的是( )
| A. | S(s,单斜)═S(s,正交)△H3=+0.33 kJ•mol-1 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJ |
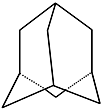 金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.
金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.