题目内容
9.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | 每生成1mol Na2Mn5O10转移2mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 若用阳离子交换膜,当电路中转移0.2mole-,负极区将减少0.4mol离子 |
分析 A.根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极;
B.方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子;
C.在原电池中阴离子向负极移动,阳离子向正极移动;
D.若用阳离子交换膜,放电时,负极的钠离子向正极移动,产生的银离子沉淀溶液中的氯离子.
解答 解:A.根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,而不是正极反应式,故A错误;
B.根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,故B正确;
C.在原电池中阴离子向负极移动,阳离子向正极移动,故C错误;
D.放电时,当电路中转移0.2mole-时,负极区有0.2mol钠离子通过阳离子交换膜向正极移动,同时会有0.2molAg失去0.2mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.2mol,则负极区中共减少0.4mol离子,故D正确;
故选:BD.
点评 本题考查原电池的电极反应和离子的定向移动以及电化学的简单计算,做题时要注意总电池反应式的判断利用,运用两极上的反应特点做题,分析Mn元素的化合价变化是该题的难点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.丙烯醇(CH2═CHCH2OH)可发生的化学反应有( )
①加成反应 ②氧化反应 ③燃烧 ④加聚反应 ⑤取代反应.
①加成反应 ②氧化反应 ③燃烧 ④加聚反应 ⑤取代反应.
| A. | ①②③④⑤ | B. | 只有①②③④ | C. | 只有①②③ | D. | 只有①③④ |
4. 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
(1)配制100mL0.10mol•L-1NaOH标准溶液.
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管等.
②称取0.4g氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、烧杯.
(2)取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用碱式滴定管(填仪器名称)装配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
(3)①滴定达到终点的现象是最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内颜色不再改变,说明达到终点.
②根据上述数据,可计算出该盐酸的浓度约为0.10 mol/L(保留小数点后二位数).
③给润洗后的滴定管中注入溶液时应C(填序号)
A.借助于漏斗 B.借助于玻璃棒 C.借助于烧杯 D.直接注入
④排去碱式滴定管中气泡的方法应采用下图操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有AD
D.滴定终点读数时俯视读
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:(1)配制100mL0.10mol•L-1NaOH标准溶液.
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管等.
②称取0.4g氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、烧杯.
(2)取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用碱式滴定管(填仪器名称)装配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.10 mol/L(保留小数点后二位数).
③给润洗后的滴定管中注入溶液时应C(填序号)
A.借助于漏斗 B.借助于玻璃棒 C.借助于烧杯 D.直接注入
④排去碱式滴定管中气泡的方法应采用下图操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有AD
D.滴定终点读数时俯视读
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
14.下列方程式正确的是( )
| A. | Ba(OH)2═Ba2++2OH- | B. | NaHSO4═Na++HSO4? | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |
1.苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为 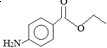 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )
 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )| A. | 分子中含有3种官能团 | |
| B. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| C. | 苯环上有2个取代基,且含有硝基的同分异构体有15种 | |
| D. | 分子式为C9H10NO2 |
18.已知aX、bY是元素周期表中除稀有气体外的短周期元素,且a-b=3,X、Y能形成化合物M,下列说法不正确的是( )
| A. | 若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 | |
| B. | 若X和Y处于同一周期,且M属于共价化合物,则分子中原子个数比可能为1:2 | |
| C. | 若最外层电子数X>Y>2,则X的非金属性一定比Y的非金属性强 | |
| D. | 若M属于离子化合物,则该化合物中只存在离子键,且每个原子均达到8电子稳定结构 |
19.下列化合物依次属于酸、碱、盐、氧化物的一组是( )
| A. | CO2 NaOH NaCl MgO | B. | H2SO4 AlCl3 CaCO3 Na2O | ||
| C. | NO2 Ba(OH)2 CaO H2O2 | D. | HBr KOH BaSO4 CuO |
 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置.