题目内容
下列溶液中,微粒浓度关系一定正确的是( )
| A、pH=6的纯水:c(OH-)<c(H+) |
| B、0.1mol?L-1的(NH4)2SO4溶液:c(NH4+)>c(SO42-)>c(H+) |
| C、常温下,pH=7的醋酸与醋酸钠的混合溶液:c(CH3COO-)>c(Na+) |
| D、常温下,pH=2的一元酸和pH=12的一元强碱等体积混合后所得溶液:c(OH-)=c(H+) |
考点:离子浓度大小的比较
专题:
分析:A、纯水水电离产生的氢离子与氢氧根离子的浓度相等;
B、(NH4)2SO4溶液水解呈酸性,二元的离子浓度大于一元的离子浓度;
C、根据电荷守恒分析;
D、常温下,pH=2的一元酸和pH=12的一元强碱等体积混合,谁显谁性.
B、(NH4)2SO4溶液水解呈酸性,二元的离子浓度大于一元的离子浓度;
C、根据电荷守恒分析;
D、常温下,pH=2的一元酸和pH=12的一元强碱等体积混合,谁显谁性.
解答:
解:A、纯水水电离产生的氢离子与氢氧根离子的浓度相等,故A错误;
B、(NH4)2SO4溶液水解呈酸性,二元的离子浓度大于一元的离子浓度,所以离子浓度为:c(NH4+)>c(SO42-)>c(H+),故B正确;
C、根据电荷守恒,可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),而pH=7,所以c(OH-)=c(H+),即c(CH3COO-)=c(Na+),故C错误;
D、常温下,pH=2的一元酸和pH=12的一元强碱等体积混合,谁显谁性,酸的强弱不知,所以无法比较两者的相对大小,故D错误;
故选B.
B、(NH4)2SO4溶液水解呈酸性,二元的离子浓度大于一元的离子浓度,所以离子浓度为:c(NH4+)>c(SO42-)>c(H+),故B正确;
C、根据电荷守恒,可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),而pH=7,所以c(OH-)=c(H+),即c(CH3COO-)=c(Na+),故C错误;
D、常温下,pH=2的一元酸和pH=12的一元强碱等体积混合,谁显谁性,酸的强弱不知,所以无法比较两者的相对大小,故D错误;
故选B.
点评:本题考查离子浓度的大小,结合电荷守恒和盐的水解综合考查,比较容易.

练习册系列答案
相关题目
在中和热测定的实验时,应使用的仪器正确组合是( )
①天平 ②量筒 ③烧杯 ④酒精灯 ⑤温度计 ⑥试管 ⑦量热计⑧环形玻璃搅拌棒.
①天平 ②量筒 ③烧杯 ④酒精灯 ⑤温度计 ⑥试管 ⑦量热计⑧环形玻璃搅拌棒.
| A、①②④⑤⑧ | B、②③⑤⑦⑧ |
| C、②③④⑦⑧ | D、全部 |
将1mol两种气态烃组成的混合气体完全燃烧后得到1.5mol CO2和2mol H2O,下列说法正确的是( )
| A、一定有乙烷 |
| B、一定有甲烷 |
| C、一定没有甲烷 |
| D、不一定有甲烷 |
 已知:NH2COO-+2H2O?HCO3-+NH3?H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )
已知:NH2COO-+2H2O?HCO3-+NH3?H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )| A、无法判断T1和T2的大小关系 |
| B、T1℃时,第6min反应物转化率为6.25% |
| C、T2℃时,0~6min ν(NH2COO-)=0.3mol?L-1?min-1 |
| D、往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |
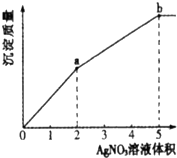 往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是( )
往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是( )| A、KSP(AgCl)<KSP(AgI) |
| B、c( Cl-):c( I-)=3:2 |
| C、m( AgCl ):m( AgI )=2:3 |
| D、a~b段产生黄色沉淀 |
利用如图所示装置(电极均为惰性电极)可吸收SO2,并制取硫酸和烧碱溶液,下列说法正确的是( )


| A、a电极反应式:SO2+2H2O-2e-═SO42-+4H+ |
| B、b极与电源的正极相连 |
| C、离子交换膜c为阳离子交换膜 |
| D、气体W为氧气 |
