题目内容
20.冶金工业中会产生对环境有污染的SO2等气体,脱去烟气中SO2的方法有多种.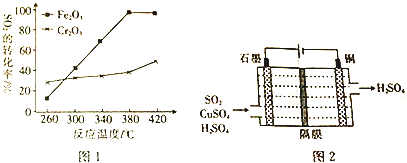
(1)热解气还原法:一定条件下,用Fe2O3或Cr2O3作催化剂除去SO2,反应的化学方程式为2CO(g)+SO2(g)$\stackrel{催化剂}{?}$2CO2(g)+S(l)△H=-270kJ•mol-1.其它条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,则应选用的催化剂是Fe2O3,则该催化剂作用下温度应控制为380°C.
(2)电解吸收法:利用如图2所示电化学装置吸收SO2,并完成Cu的再生,写出该装置的阳极反应式:SO2+2H2O-2e-=4H++SO42-,溶液中Cu2+由左(填“左”或“右”,下同)向右移动.
(3)氧化锌吸收法:配制ZnO溶悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO+SO2=ZnSO3(s),该反应常温下能自发进行的原因是△H<0.
分析 (1)Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源,图象分析二氧化硫转化率和温度关系选择温度;
(2)电解池中吸收工业尾气中SO2,阴极上生成Cu,阳极是二氧化硫失电子发生氧化反应生成硫酸根离子;电解过程中阴离子移向阳极;
(3)根据△G=△H-T•△S判断,反应能自发进行,必须满足△H-T•△S<0.
解答 解:(1)Fe2O3作催化剂时,在相对较低温度可获得较高的SO2转化率,从而节约能源,故选Fe2O3作催化剂,图象分析可知温度在380°C时选Fe2O3作催化剂,二氧化硫转化率最大,
故答案为:Fe2O3;380°C;
(2)电解池中吸收工业尾气中SO2,阴极上生成Cu,阳极是二氧化硫失电子发生氧化反应生成硫酸根离子,电极反应为:SO2+2H2O-2e-=4H++SO42-,溶液中Cu2+是阳离子,通电后阳离子移向阴极,铜离子左移向右,
故答案为:SO2+2H2O-2e-=4H++SO42-;左;右;
(3)应能够自发进行,必须满足:△G=△H-T•△S<0,由于反应ZnO+SO2=ZnSO3(s)的△S<0,则-T•△S>0,该反应在常温下能够进行,则必须满足:△H<0,
故答案为:△H<0.
点评 题考查了二氧化硫的污染与治理、图象分析、反应自发进行的判断依据、电解池原理等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,掌握二氧化硫的治理原理,明确电解池原理是解题关键.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
11.下列说法正确的是( )
| A. | 需要加热才发生的化学反应,反应物的总能量可能高于生成物的总能量 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
15.1mol•L-1的稀醋酸中存在平衡:CH3COOH?CH3COO-+H+.下列说法正确的是( )
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1盐酸,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
5.化学与资源、环境、生活关系密切,下列说法正确的是( )
| A. | 空气中PM2.5(2.5微米以下的颗粒物)的存在能够形成丁达尔效应 | |
| B. | 煤燃烧时加入少量的生石灰可以减少废气中的二氧化硫排放 | |
| C. | 将造纸废水通过高压水井压到地下,节约生产成本 | |
| D. | 绿色化学的核心是应用呼吸原理对环境污染进行治理 |
 .
. 某学生在如图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题:
某学生在如图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题: .
.