题目内容
某研究性学习小组同学向Fe(NO3)3溶液中滴加淀粉KI溶液后,溶液呈蓝色.他们对Fe(NO3)3溶液中将I-氧化的氧化剂进行了如下探究:
【实验】分别向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,发现溶液均显蓝色.
(1)FeCl3溶液与KI溶液反应的离子方程式为 .
(2)KI与HNO3反应的离子方程式为I-+H++NO3-→NO↑+I2+H2O(未配平),反应中氧化剂与还原剂的物质的量之比为 .
【提出假设】假设1:氧化剂只有Fe3+
假设2:氧化剂只有NO3-(H+)
【设计实验方案,验证假设】
(3)请设计实验验证上述假设
供选试剂:0.2mol?L-1的Fe(NO3)3溶液、0.2mol?L-1的KI溶液、0.01mol?L-1的KMnO4酸性溶液、0.01mol?L-1的KSCN溶液、CCl4溶液、淀粉溶液.(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
【思考与交流】(4)若Fe(NO3)3与KI反应的过程中,Fe3+和NO3-(H+)均参与氧化I-,则上述实验中步骤②和③的预期现象分别是什么? .
【实验】分别向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,发现溶液均显蓝色.
(1)FeCl3溶液与KI溶液反应的离子方程式为
(2)KI与HNO3反应的离子方程式为I-+H++NO3-→NO↑+I2+H2O(未配平),反应中氧化剂与还原剂的物质的量之比为
【提出假设】假设1:氧化剂只有Fe3+
假设2:氧化剂只有NO3-(H+)
【设计实验方案,验证假设】
(3)请设计实验验证上述假设
供选试剂:0.2mol?L-1的Fe(NO3)3溶液、0.2mol?L-1的KI溶液、0.01mol?L-1的KMnO4酸性溶液、0.01mol?L-1的KSCN溶液、CCl4溶液、淀粉溶液.(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
| 实验步骤 | 预期现象和结论 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 | |
| ② ③ | 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)铁离子具有氧化性,碘离子具有还原性,二者之间发生氧化还原反应;
(2)根据电子守恒、元素守恒配平方程式,得到氧化剂和还原剂的物质的量之比;
(3)铁离子的还原产物是亚铁离子,根据反应后的产物是否有亚铁离子检验铁离子的氧化性是否表现出来:加入硫氰化钾,若变红,则含铁离子,此时铁离子没有表现氧化性,硝酸表现氧化性;加入高锰酸钾,若显示紫色,则溶液不含亚铁离子,铁离子不变化,没有表现氧化性,硝酸表现氧化性;
(4)铁离子的还原产物是亚铁离子,能使高锰酸钾褪色,铁离子遇到硫氰化钾显红色,据此回答.
(2)根据电子守恒、元素守恒配平方程式,得到氧化剂和还原剂的物质的量之比;
(3)铁离子的还原产物是亚铁离子,根据反应后的产物是否有亚铁离子检验铁离子的氧化性是否表现出来:加入硫氰化钾,若变红,则含铁离子,此时铁离子没有表现氧化性,硝酸表现氧化性;加入高锰酸钾,若显示紫色,则溶液不含亚铁离子,铁离子不变化,没有表现氧化性,硝酸表现氧化性;
(4)铁离子的还原产物是亚铁离子,能使高锰酸钾褪色,铁离子遇到硫氰化钾显红色,据此回答.
解答:
解:(1)铁离子具有氧化性,碘离子具有还原性,二者之间发生氧化还原反应,即2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(2)反应I-+H++NO3-→NO↑+I2+H2O中,N的化合价降低了3价,所以NO3-是氧化剂,碘元素的化合价升高了2价,所以碘离子是还原剂,根据电子守恒,N元素系数是2,碘离子前边是6,碘单质前边是3,根据电荷守恒,氢离子前边是8,水前边是4,即6I-+8H++2NO3-=2NO↑+3I2+4H2O,氧化剂和还原剂的物质的量之比是1:3,
故答案为:1﹕3;
(3)取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中,向试管A中加入1~2滴0.01 mol?L-1的KSCN溶液,若不变红色,则没有铁离子,氧化剂只有Fe3+,向试管B中加入1~2滴0.01 mol?L-1的KMnO4酸性溶液,若溶液显紫色,则不含亚铁离子,铁离子没有表现氧化性,氧化剂只有NO3-(H+),故答案为:
(4)若Fe(NO3)3与KI反应的过程中,Fe3+和NO3-(H+)均参与氧化I-,即溶液中含亚铁离子,还有铁离子,则步骤②中溶液变红色,步骤③中溶液不显紫色,
故答案为:步骤②中溶液变红色,步骤③中溶液不显紫色.
(2)反应I-+H++NO3-→NO↑+I2+H2O中,N的化合价降低了3价,所以NO3-是氧化剂,碘元素的化合价升高了2价,所以碘离子是还原剂,根据电子守恒,N元素系数是2,碘离子前边是6,碘单质前边是3,根据电荷守恒,氢离子前边是8,水前边是4,即6I-+8H++2NO3-=2NO↑+3I2+4H2O,氧化剂和还原剂的物质的量之比是1:3,
故答案为:1﹕3;
(3)取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中,向试管A中加入1~2滴0.01 mol?L-1的KSCN溶液,若不变红色,则没有铁离子,氧化剂只有Fe3+,向试管B中加入1~2滴0.01 mol?L-1的KMnO4酸性溶液,若溶液显紫色,则不含亚铁离子,铁离子没有表现氧化性,氧化剂只有NO3-(H+),故答案为:
| 实验步骤 | 预期现象和结论 |
| ②向试管A中加入1~2滴0.01 mol?L-1的KSCN溶液 ③向试管B中加入1~2滴0.01 mol?L-1的 KMnO4酸性溶液 |
故答案为:步骤②中溶液变红色,步骤③中溶液不显紫色.
点评:本题是一道实验探究题,涉及离子的检验以及实验方案的设计知识,难度较大.

练习册系列答案
相关题目
若NA表示阿佛加德罗常数,下列说法正确的是( )
| A、1 mol氦气分子中含2NA个氦原子 |
| B、25℃时,l L pH=13的Ba(OH)2 溶液中含有OH-的数目为0.1NA |
| C、1.8 g重水(21H2O)中所含质子的个数为NA |
| D、1L 0.2mol/L的FeCl3溶液中Fe3+的数目为0.2NA |
在苯和苯酚组成的混合物中,碳元素的质量分数为90% 则混合物中氧元素的质量分数为( )
| A、2.5% | B、5% |
| C、6.5% | D、7.5% |
如图为一“链环”图案,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号.下列分类依据错误的是( )
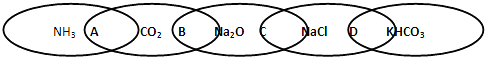

| A、两种物质都是电解质 |
| B、两种物质都是氧化物 |
| C、两种物质都是钠的化合物 |
| D、两种物质都是盐 |
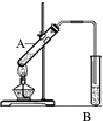 (1)实验室用右图所示装置制取乙酸乙酯,在试管A中加入的试剂有无水酒精、浓硫酸和冰醋酸(CH3COOH).请写出该反应的化学方程式)
(1)实验室用右图所示装置制取乙酸乙酯,在试管A中加入的试剂有无水酒精、浓硫酸和冰醋酸(CH3COOH).请写出该反应的化学方程式)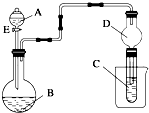 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题: