题目内容
某生用容积为2L的密闭容器做实验,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:
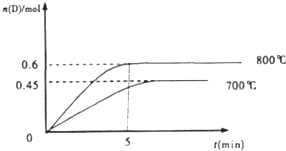
(1)800℃时,0-5min内,以B表示的平均反应速率为 .
(2)能判断该反应达到化学平衡状态的依据是 .
A.容器中压强不变B.混合气体中c(A)不变C.2v正(B)=v逆(D)D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为 反应(填吸热或放热)
(4)800℃,某时刻测得体系中各物质的量为:n(A)=1.2mol,n(B)=2.0mol,n(C)=4.0mol,n(D)=2.0mol,则此时该反应向 方向进行(填“正反应”“逆反应”或“处于平衡状态”).

(1)800℃时,0-5min内,以B表示的平均反应速率为
(2)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变B.混合气体中c(A)不变C.2v正(B)=v逆(D)D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=
(4)800℃,某时刻测得体系中各物质的量为:n(A)=1.2mol,n(B)=2.0mol,n(C)=4.0mol,n(D)=2.0mol,则此时该反应向
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)先根据v=
计算D的反应速率,再根据同一化学反应中,各物质的反应速率之比等于其计量数之比计算B的反应速率;
(2)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
(3)先计算平衡时各物质的浓度,再根据平衡常数公式计算化学平衡常数,升高温度,平衡向吸热反应方向移动,根据D物质的量的变化确定反应热;
(4)根据浓度商和化学平衡常数的相对大小判断,如果浓度商大于化学平衡常数,则反应向 正反应方向移动,如果浓度商小于化学平衡常数,则反应向逆反应方向移动.
| ||
| △t |
(2)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
(3)先计算平衡时各物质的浓度,再根据平衡常数公式计算化学平衡常数,升高温度,平衡向吸热反应方向移动,根据D物质的量的变化确定反应热;
(4)根据浓度商和化学平衡常数的相对大小判断,如果浓度商大于化学平衡常数,则反应向 正反应方向移动,如果浓度商小于化学平衡常数,则反应向逆反应方向移动.
解答:
解:(1)v(D)=
=0.06mol?L-1?min-1,
,该反应中,v(B)=2v(D)=0.12mol/(L.min),
故答案为:0.12mol/(L.min);
(2)A.该反应是一个反应前后气体体积减小的可逆反应,当反应到达平衡状态时,容器中压强不变,所以能作为判断化学平衡的依据,故正确;
B.反应到达平衡状态时,混合气体中c(A)不变,故正确;
C.当v正(B)=2v逆(D)时,该反应达到平衡状态,故错误;
D.当c(A)=c(C)时,该反应不一定达到平衡状态,这样反应物浓度及转化率有关,故错误;
故选AB;
(3)若最初加入1.0molA和2.2molB,设参加反应的A为nmol,
A(g)+2B(g)?C(g)+D(g)
初始的量:(mol) 1.0 2.2 0 0
反应的量:(mol) n 2n n n
平衡的量:(mol) 1-n 2.2-2n n n
由图象可知平衡时D的物质的量为0.6mol,即n=0.6mol,则平衡时c(A)=
=0.2mol/L,c(B)=0.5mol/L,
c(C)=c(D)=
=0.3mol/L,则K=
=1.8,
,升高温度,D的含量增大,说明平衡向正反应方向移动,则正反应是吸热反应,
故答案为:1.8;吸热;
(4)n(A)=1.2mol,n(B)=2.0mol,n(C)=4.0mol,n(D)=2.0mol,所以各物质的浓度分别为:c(A)=0.6mol/L,c(B)=1.0mol/L,c(C)=2mol/L,c(D)=1mol/L,
Q=
=3.33>1.8,则平衡向逆反应方向移动,
故答案为:逆反应.
| ||
| 5min |
,该反应中,v(B)=2v(D)=0.12mol/(L.min),
故答案为:0.12mol/(L.min);
(2)A.该反应是一个反应前后气体体积减小的可逆反应,当反应到达平衡状态时,容器中压强不变,所以能作为判断化学平衡的依据,故正确;
B.反应到达平衡状态时,混合气体中c(A)不变,故正确;
C.当v正(B)=2v逆(D)时,该反应达到平衡状态,故错误;
D.当c(A)=c(C)时,该反应不一定达到平衡状态,这样反应物浓度及转化率有关,故错误;
故选AB;
(3)若最初加入1.0molA和2.2molB,设参加反应的A为nmol,
A(g)+2B(g)?C(g)+D(g)
初始的量:(mol) 1.0 2.2 0 0
反应的量:(mol) n 2n n n
平衡的量:(mol) 1-n 2.2-2n n n
由图象可知平衡时D的物质的量为0.6mol,即n=0.6mol,则平衡时c(A)=
| 1-0.6 |
| 2 |
c(C)=c(D)=
| 0.6mol |
| 2L |
| 0.3×0.3 |
| 0.2×0.52 |
,升高温度,D的含量增大,说明平衡向正反应方向移动,则正反应是吸热反应,
故答案为:1.8;吸热;
(4)n(A)=1.2mol,n(B)=2.0mol,n(C)=4.0mol,n(D)=2.0mol,所以各物质的浓度分别为:c(A)=0.6mol/L,c(B)=1.0mol/L,c(C)=2mol/L,c(D)=1mol/L,
Q=
| 1×2 |
| 0.6×12 |
故答案为:逆反应.
点评:本题涉及化学反应速率的计算、化学平衡状态的判断、化学平衡常数的计算等知识点,注意分析化学方程式的特征以及温度对平衡移动的影响.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
一定温度下的密闭容器中发生可逆反应C(s)+H2O(g)?CO(g)+H2(g),一定能说明该反应已达到平衡状态的是( )
| A、v逆(H2O)=v正(CO) |
| B、容器中物质的总质量不发生变化 |
| C、n(H2O):n(H2)=1:1 |
| D、生成1molCO的同时生成1molH2 |
 开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列关于该有机物的说法正确的是( )
开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列关于该有机物的说法正确的是( )| A、该有机物的分子式是C22H23N2O2Cl |
| B、分子中含有四个六元环,其中有一个是苯环 |
| C、1mol分子发生水解反应后能得到2mol新分子 |
| D、1mol分子发生加成反应需要8mol H2 |
下列说法正确的是( )
| A、蒸发是为了除去溶剂得到晶体,蒸馏是为了得到液体成分 |
| B、金属氧化物一定是碱性氧化物 |
| C、酸性氧化物一定是非金属氧化物 |
| D、物质的量是七个基本物理量之一,是用于描述一定粒子数目的物理量 |
下列各化学式中,只表示一种纯净物的是( )
| A、C2H4O2 |
| B、C3H6 |
| C、C2H3Br |
| D、C3H6O |