题目内容
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②由上表数据可知该反应为放热反应,理由是
③理论上,为了增大平衡时H2的转化率,可采取的措施是
a.增大压强 b.使用合适的催化剂c.升高温度 d.及时分离出产物中的NH3
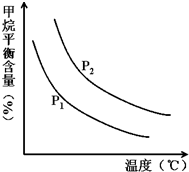
(2)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,向容积固定为5L的容器中充入1mol水蒸气和1mol CH4,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1
该反应为
②T℃时,反应达平衡后,测得CO的浓度为0.08mol?L-1,则平衡时CH4的转化率为
③下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CH4的同时消耗a mol H2
d.混合气中n(CH4):n(H2O):n(CO):n(H2)=1:1:1:3.
考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)①工业合成氨是氮气和氢气在催化剂作用下高温高压反应生成氨气;
②依据图标数据分析,平衡常数随温度升高减小,平衡逆向进行说明反应是放热反应
③为了增大平衡时H2的转化率,平衡正向进行分析选项;
(2)①依据图象变化分析,相同温度下,CH4(g)+H2O (g)═CO(g)+3H2(g),反应是气体体积增大的反应,压强越大,平衡逆向进行,甲烷平衡含量越高;
②压强一定,温度升高,甲烷平衡含量减小,平衡正向进行,依据平衡移动原理分析判断;
(3)①依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
②化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项.
②依据图标数据分析,平衡常数随温度升高减小,平衡逆向进行说明反应是放热反应
③为了增大平衡时H2的转化率,平衡正向进行分析选项;
(2)①依据图象变化分析,相同温度下,CH4(g)+H2O (g)═CO(g)+3H2(g),反应是气体体积增大的反应,压强越大,平衡逆向进行,甲烷平衡含量越高;
②压强一定,温度升高,甲烷平衡含量减小,平衡正向进行,依据平衡移动原理分析判断;
(3)①依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
②化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项.
解答:
解:(1)①合成氨的化学方程式为N2+3H2
2NH3,故答案为:N2+3H2
2NH3;
②图表中平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,故答案为:随温度升高,反应的平衡常数K减小;
③反应是N2+3H2
2NH3,反应是气体体积减小的放热反应,为了增大平衡时H2的转化率,平衡正向进行分析,
a.增大压强,平衡正向进行,氢气转化率增大,故a符合;
b.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故b不符合;
c.升高温度平衡逆向进行,氢气转化率减小,故c不符合;
d.及时分离出产物中的NH3,平衡正向进行,氢气转化率增大,故d符合;
故答案为:ad;
(2)①依据图象变化分析,相同温度下,CH4(g)+H2O (g)═CO(g)+3H2(g),反应是气体体积增大的反应,压强越大,平衡逆向进行,甲烷平衡含量越高,所以P2>P1;压强一定,温度升高,甲烷平衡含量减小,平衡正向进行,正反应为吸热反应;故答案为:<;吸热;
②向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol?L-1,
CH4(g)+H2O (g)?CO(g)+3H2(g)
起始量(mol/L) 0.2 0.2 0 0
变化量(mol/L) 0.08 0.08 0.08 0.08
平衡量(mol/L) 0.12 0.12 0.108 0.08
平衡时CH4的转化率=
×100%=40%
则该温度下反应的平衡常数K=
=0.038
故答案为:40%;0.038;
③化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项,CH4(g)+H2O (g)?CO(g)+3H2(g),反应后气体体积增大;
a.正反应气体体积增大,容器内压强不随时间改变,能说明反应达到平衡状态,故a符合;
b.混合气体质量守恒,容器体积不变,反应过程中和平衡状态下,混合气体的密度不随时间改变,不能说明反应达到平衡状态,故b不符合;
c.单位时间内生成amolCH4的同时消耗amolH2,都是逆反应速率,且不符合化学计量数之比,不能说明正逆反应速率相同,不能说明反应达到平衡状态,故c不符合;
d.混合气中各组分物质的量之比决定于反应开始时加入的多少,故d不符合;
故答案为:a.
| ||
| 高温高压 |
| ||
| 高温高压 |
②图表中平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,故答案为:随温度升高,反应的平衡常数K减小;
③反应是N2+3H2
| ||
| 高温高压 |
a.增大压强,平衡正向进行,氢气转化率增大,故a符合;
b.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故b不符合;
c.升高温度平衡逆向进行,氢气转化率减小,故c不符合;
d.及时分离出产物中的NH3,平衡正向进行,氢气转化率增大,故d符合;
故答案为:ad;
(2)①依据图象变化分析,相同温度下,CH4(g)+H2O (g)═CO(g)+3H2(g),反应是气体体积增大的反应,压强越大,平衡逆向进行,甲烷平衡含量越高,所以P2>P1;压强一定,温度升高,甲烷平衡含量减小,平衡正向进行,正反应为吸热反应;故答案为:<;吸热;
②向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol?L-1,
CH4(g)+H2O (g)?CO(g)+3H2(g)
起始量(mol/L) 0.2 0.2 0 0
变化量(mol/L) 0.08 0.08 0.08 0.08
平衡量(mol/L) 0.12 0.12 0.108 0.08
平衡时CH4的转化率=
| 0.08mol/L |
| 0.2mol/L |
则该温度下反应的平衡常数K=
| 0.08×0.08 |
| 0.12×0.12 |
故答案为:40%;0.038;
③化学平衡状态,反应的正逆反应速率相同,各成分含量保持不变分析选项,CH4(g)+H2O (g)?CO(g)+3H2(g),反应后气体体积增大;
a.正反应气体体积增大,容器内压强不随时间改变,能说明反应达到平衡状态,故a符合;
b.混合气体质量守恒,容器体积不变,反应过程中和平衡状态下,混合气体的密度不随时间改变,不能说明反应达到平衡状态,故b不符合;
c.单位时间内生成amolCH4的同时消耗amolH2,都是逆反应速率,且不符合化学计量数之比,不能说明正逆反应速率相同,不能说明反应达到平衡状态,故c不符合;
d.混合气中各组分物质的量之比决定于反应开始时加入的多少,故d不符合;
故答案为:a.
点评:本题考查了化学平衡影响因素,平衡标志分析,平衡常数的计算应用,主要是图象分析判断,平衡移动原理的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
常温下,下列溶液中各离子浓度关系正确的是( )
| A、等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3?H2O) |
| B、浓度为0.1 mol?L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、将pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
下列微粒对CH3COO-+H2O?CH3COOH+OH- 水解平衡有影响的是( )
| A、H3O+ |
B、 |
| C、NO3- |
| D、Ba2+ |
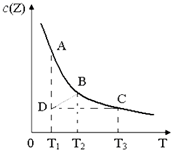 已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )
已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )| A、B点对应的反应速率大于C点对应的反应速率 |
| B、状态A的c(Y)大于状态D c(Y) |
| C、反应X(g)+3Y(g)?2Z(g)的△H<0 |
| D、其他条件不变,缩小容器的体积,平衡可由D点移动到B点 |
下列关于物质的用途的叙述错误的是( )
| A、水玻璃是制造太阳能电池的常用材料 |
| B、雕花玻璃可以利用氢氟酸对玻璃进行刻蚀而制成 |
| C、常温下可用铁、铝制容器来盛装浓硝酸或浓硫酸 |
| D、氯气可用于自来水厂的杀菌、消毒 |
室内空气污染的重要来源之一是人们现代生活中所使用的化工产品、家具、墙纸、化纤地毯、塑料地毯等会不同程度地释放出某种有害气体.该气体是( )
| A、甲醛 | B、二氧化碳 |
| C、一氧化碳 | D、甲烷 |
已知:2FeSO4?7H2O
Fe2O3+SO2↑+SO3↑+14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是( )
| ||
| A、有BaSO4生成 |
| B、有BaSO3生成 |
| C、同时有BaSO4和BaSO3生成 |
| D、无明显现象发生 |
下列各种镀有金属保护层的铁板,当镀层破损时相同的普通环境中,最易被腐蚀的是( )
| A、镀锌铁(白铁) |
| B、镀锡铁(马口铁) |
| C、镀银铁 |
| D、镀铜铁 |
设为阿伏加德罗常数的值,下列说法不正确的是( )
| A、标准状况下,22.4L水中含有的氧原子数为NA |
| B、0.3molNO2与水反应时转移的电子数为0.2NA |
| C、标准状况下,28gN2和CO所组成的混合气体,其体积为22.4L |
| D、足量铁粉与1molCl2在加热条件下充分反应,转移的电子数为2NA |