题目内容
在一定温度下,一定体积的密闭容器中有如下平衡:H2(气)+I2(气)?2HI(气)
已知H2和I2的起始浓度均为0.01mol?L-1时,达平衡时HI的浓度为0.16mol?L-1.若H2和I2的起始浓度均变为0.20mol?L-1,则平衡时H2的浓度(mol?L-1)是( )
已知H2和I2的起始浓度均为0.01mol?L-1时,达平衡时HI的浓度为0.16mol?L-1.若H2和I2的起始浓度均变为0.20mol?L-1,则平衡时H2的浓度(mol?L-1)是( )
| A、0.16 | B、0.08 |
| C、0.04 | D、0.02 |
考点:化学平衡的计算,化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:因温度不变,则两种情况下平衡常数相同,利用“H2和I2的起始浓度均为0.01mol?L-1时,达平衡时HI的浓度为0.16mol?L-1”计算K,再利用三段法计算,以此来解答.
解答:
解:H2(g)+I2(g) 2HI(g)
2HI(g)
起始浓度0.10mol?L-1 0.10mol?L-1 0
反应浓度0.08mol?L-1 0.08mol?L-1 0.16mol?L-1
平衡浓度0.02mol?L-1 0.02mol?L-1 0.16mol?L-1
化学平衡常数K=
=64,
则H2和I2的起始浓度均变为0.20mol?L-1时,设则平衡时H2的浓度为x(mol?L-1),氢气的反应浓度为( 0.20-x)mol?L-1,
H2(g)+I2(g) 2HI(g)
2HI(g)
起始浓度 0.20mol?L-1 0.20mol?L-1 0
反应浓度 (0.20-x)mol?L-1 (0.20-x)mol?L-1 2(0.20-x)mol?L-1
平衡浓度 x x 2(0.20-x)mol?L-1
K=
=64,解得x=0.04,
故选C.
 2HI(g)
2HI(g)起始浓度0.10mol?L-1 0.10mol?L-1 0
反应浓度0.08mol?L-1 0.08mol?L-1 0.16mol?L-1
平衡浓度0.02mol?L-1 0.02mol?L-1 0.16mol?L-1
化学平衡常数K=
| (0.16)2 |
| 0.02×0.02 |
则H2和I2的起始浓度均变为0.20mol?L-1时,设则平衡时H2的浓度为x(mol?L-1),氢气的反应浓度为( 0.20-x)mol?L-1,
H2(g)+I2(g)
 2HI(g)
2HI(g)起始浓度 0.20mol?L-1 0.20mol?L-1 0
反应浓度 (0.20-x)mol?L-1 (0.20-x)mol?L-1 2(0.20-x)mol?L-1
平衡浓度 x x 2(0.20-x)mol?L-1
K=
| (0.04-2x)2 |
| x×x |
故选C.
点评:本题考查化学平衡的计算,为高考常见题型,把握温度不变则K不变为解答的关键,注重分析与计算能力的考查,注意三段法在计算中的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列关于难溶电解质的溶解平衡描述中正确的是( )
| A、沉淀溶解达到平衡时,溶液中各离子的浓度一定相等 |
| B、沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C、难溶电解质的溶解平衡是一种动态平衡,可以通过改变条件使平衡移动 |
| D、沉淀转化的实质就是沉淀溶解平衡的移动,一般说来,溶解度小的沉淀转化成溶解度大的沉淀更容易实现 |
下表是3种物质的溶解度(20℃),下列说法中正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g) | 74 | 0.0009 | 0.02 |
| A、已知MgCO3的Ksp=6.8×10-6(mol?L-1)2,则所有含固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.8×10-6 (mol?L-1)2 |
| B、将MgCl2与水混合,再对溶液蒸干、灼烧,最终所得固体产物为MgO |
| C、除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
| D、用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
常温下,下列溶液中各离子浓度关系正确的是( )
| A、等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3?H2O) |
| B、浓度为0.1 mol?L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、将pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
下列对有机物结构或性质的描述,错误的是( )
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B、一定条件下,乙醇可发生消去反应,甲醇也可发生消去反应 |
| C、标准状况下,22.4L乙烷和丙烯的混合物,完全燃烧生成3 mol H2O |
| D、在光照作用下,2,2-二甲基丙烷与Br2反应其一溴取代物只有一种 |
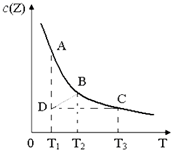 已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )
已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )| A、B点对应的反应速率大于C点对应的反应速率 |
| B、状态A的c(Y)大于状态D c(Y) |
| C、反应X(g)+3Y(g)?2Z(g)的△H<0 |
| D、其他条件不变,缩小容器的体积,平衡可由D点移动到B点 |

