题目内容
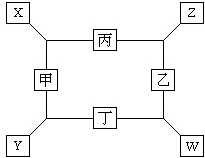 如图所示,已知:
如图所示,已知:①甲、乙、丙、丁均为核电荷数为1~18号元素的单质,甲、乙、丙在常温下均为气体,丁元素的原子核外有3个电子层,最外层有2个电子;
②在一定条件下甲与丙和甲与丁都按物质的量之比为1:3的比例反应,分别生成X和Y,在产物中元素甲呈负价,且Y的摩尔质量为100g?mol-1;
③在一定条件下乙与丙和乙与丁都按物质的量之比为1:2的比例反应,分别生成Z和W,在产物中元素乙呈负价.请回答:
(1)W的化学式为
(2)X与乙催化氧化的化学方程式是
(3)Y与Z反应的化学方程式是
(4)丁与足量的乙反应生成W的化学方程式为
(5)实验室制取丙的离子方程式为
考点:无机物的推断
专题:
分析:甲、乙、丙均为前三周期元素的气体单质为H2、O2、N2、Cl2,丁元素的原子核外有3个电子层,最外层有2个电子判断丁为:Mg;在一定条件下甲与丙、甲与丁都按微粒个数比1:3组成X和Y,在产物中元素甲呈负价,且Y的摩尔质量为100g?mol-1,说明甲是非金属元素形成的单质N2,丙为H2,X为NH3,Y为Mg3N2;在一定条件下乙与丙、乙与丁都按物质的量之比1:2反应,在产物中元素乙呈负价,说明乙是非金属元素.所以乙为O2,分别生成Z为H2O,W为MgO;依据判断出的物质分析回答问题.
解答:
解:甲、乙、丙均为前三周期元素的气体单质为H2、O2、N2、Cl2,丁元素的原子核外有3个电子层,最外层有2个电子判断丁为:Mg;在一定条件下甲与丙、甲与丁都按微粒个数比1:3组成X和Y,在产物中元素甲呈负价,且Y的摩尔质量为100g?mol-1,说明甲是非金属元素形成的单质N2,丙为H2,X为NH3,Y为Mg3N2;在一定条件下乙与丙、乙与丁都按物质的量之比1:2反应,在产物中元素乙呈负价,说明乙是非金属元素.所以乙为O2,分别生成Z为H2O,W为MgO;依据判断出的物质分析回答问题.
(1)W为MgO,形成的是离子化合物;
故答案为:MgO;
(2)甲与丙反应生成X的反应是氨气和氢气合成氨的反应,X与乙催化氧化的化学方程式是:4NH3+5O2
4NO+6H2O;
故答案为:4NH3+5O2
4NO+6H2O
(3)Y与Z反应是氮化镁和水反应生成氢氧化镁和氨气,反应的化学方程式是:Mg3N2+6H2O═3Mg(OH)2+2NH3↑;
故答案为:Mg3N2+6H2O═3Mg(OH)2+2NH3↑;
(4)丁与足量的乙反应生成W的化学方程式为2Mg+O2
2MgO;
故答案为:2Mg+O2
2MgO;
(5)实验室制取丙为H2,利用锌和稀硫酸反应生成,反应离子方程式为Zn+2H+═Zn2++H2↑;
故答案为:Zn+2H+═Zn2++H2↑;
(1)W为MgO,形成的是离子化合物;
故答案为:MgO;
(2)甲与丙反应生成X的反应是氨气和氢气合成氨的反应,X与乙催化氧化的化学方程式是:4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(3)Y与Z反应是氮化镁和水反应生成氢氧化镁和氨气,反应的化学方程式是:Mg3N2+6H2O═3Mg(OH)2+2NH3↑;
故答案为:Mg3N2+6H2O═3Mg(OH)2+2NH3↑;
(4)丁与足量的乙反应生成W的化学方程式为2Mg+O2
| ||
故答案为:2Mg+O2
| ||
(5)实验室制取丙为H2,利用锌和稀硫酸反应生成,反应离子方程式为Zn+2H+═Zn2++H2↑;
故答案为:Zn+2H+═Zn2++H2↑;
点评:本题考查了物质性质的应用和物质转化关系的推断和判断,主要考查原子结构特征、反应定量关系应用、电子式书写,化学方程式的书写,物质组成的特征是解题的关键,题目难度中等.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目
下列有关说法正确的是(NA为阿伏加德罗常数)( )
| A、1.00molNaCl中含有NA个NaCl分子 |
| B、欲配制1.00L,1.00mol.L-1的NaCl溶液,可将58.5gNaCl溶于 1.00L水 |
| C、1.12L Cl2含有1.7NA个质子 |
| D、1molCl2与足量的铁反应,转移的电子数为2NA |
相同体积的Na2SO4,MgSO4,Al2(SO4)3,溶液分别加入过量的BaCl2,得到沉淀的物质的量之比为1:1:3,这三种溶液的物质的量浓度之比为( )
| A、2:2:3 |
| B、1:1:3 |
| C、1:1:1 |
| D、3:3:1 |
室温时将100mLH2S和O2的混合气体,点燃完全反应后恢复到原来状况,体积变为40mL.下列叙述中正确的是( )
| A、剩余40mL气体一定是O2 |
| B、剩余40mL气体是H2S或SO2 |
| C、混合气体中含H2S 40mL或80mL |
| D、剩余40mL气体是SO2和O2混合气体 |
 燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”.
燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”. )具有强烈的类似素馨花青甜膏香,主要用于柏木,风信子,紫丁香,水仙,葵花香型皂用和洗衣粉香精中.以下是某课题组开发的从廉价、易得的化工原料出发制备E-β-溴代苏合香烯的合成路线:
)具有强烈的类似素馨花青甜膏香,主要用于柏木,风信子,紫丁香,水仙,葵花香型皂用和洗衣粉香精中.以下是某课题组开发的从廉价、易得的化工原料出发制备E-β-溴代苏合香烯的合成路线:


 铁及铁的化合物用途非常广泛.
铁及铁的化合物用途非常广泛. 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.