题目内容
相同体积的Na2SO4,MgSO4,Al2(SO4)3,溶液分别加入过量的BaCl2,得到沉淀的物质的量之比为1:1:3,这三种溶液的物质的量浓度之比为( )
| A、2:2:3 |
| B、1:1:3 |
| C、1:1:1 |
| D、3:3:1 |
考点:离子方程式的有关计算
专题:离子反应专题
分析:加入足量的BaCl2溶液,硫酸根完全沉淀生成BaSO4,生成沉淀BaSO4的物质的量之比为1:1:3,根据硫酸根守恒计算n(Na2SO4)、n(MgSO4)、n[Al2(SO4)3],溶液的体积相同,物质的量浓度之比等于物质的量之比.
解答:
解:加入足量的BaCl2溶液,硫酸根完全沉淀生成BaSO4,生成沉淀BaSO4的物质的量之比为1:1:3,令BaSO4的物质的量为1mol、1mol、3mol;
根据硫酸根离子守恒,则:
n(Na2SO4)=n(BaSO4)=1mol
n(MgSO4)=n(BaSO4)=1mol
n[Al2(SO4)3]=
n(BaSO4)=
×3mol=1mol,
三种溶液的体积相同,物质的量浓度之比等于物质的量之比,故相同体积的Na2SO4、MgSO4、Al2(SO4)3溶液的物质的量浓度之比为1mol:1mol:1molmol=1:1:1,
故选C.
根据硫酸根离子守恒,则:
n(Na2SO4)=n(BaSO4)=1mol
n(MgSO4)=n(BaSO4)=1mol
n[Al2(SO4)3]=
| 1 |
| 3 |
| 1 |
| 3 |
三种溶液的体积相同,物质的量浓度之比等于物质的量之比,故相同体积的Na2SO4、MgSO4、Al2(SO4)3溶液的物质的量浓度之比为1mol:1mol:1molmol=1:1:1,
故选C.
点评:本题考查物质的量浓度的有关计算,难度不大,掌握上述化学反应的实质是计算的关键,注意利用假设法与守恒法进行的计算.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
下列说法正确的是( )
①水玻璃、福尔马林、淀粉、Fe(OH)3胶体均为混合物
②1H、2H、3H互为同位素
③用紫色石蕊试液检验HCHO溶液是否被氧化
④酸化的Ba(NO3)2溶液和品红溶液都能将SO2和CO2气体区别开
⑤NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
⑥常温下,向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使溶液呈中性,此时溶液中浓度最大的离子为铵根离子.
①水玻璃、福尔马林、淀粉、Fe(OH)3胶体均为混合物
②1H、2H、3H互为同位素
③用紫色石蕊试液检验HCHO溶液是否被氧化
④酸化的Ba(NO3)2溶液和品红溶液都能将SO2和CO2气体区别开
⑤NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
⑥常温下,向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使溶液呈中性,此时溶液中浓度最大的离子为铵根离子.
| A、①③④⑥ | B、①②③ |
| C、④⑤⑥ | D、除⑤以外 |
下列说法错误的是( )
| A、在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 |
| B、人们常采用牺牲阳极保护法防止通讯电缆发生腐蚀 |
| C、在电镀槽中,镀件做阴极,阳极选用镀层金属 |
| D、用惰性电极电解某硫酸铜溶液一段时间后,要恢复溶液的成分和浓度,可向溶液中加入一定量的氧化铜 |

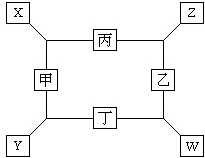 如图所示,已知:
如图所示,已知:


 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.