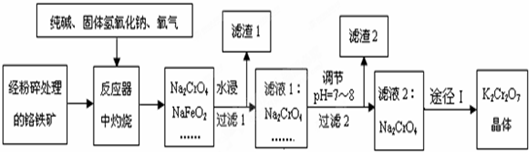
题目内容
 铁及铁的化合物用途非常广泛.
铁及铁的化合物用途非常广泛.(1)Fe3O4具有很好的磁性,是一种复杂的氧化物,在实验室可由Fe粉与
(2)高铁酸钾(K2FeO4)是一种新型非氯高效消毒剂,该化合物中铁元素的化合价为
(3)Fe2O3在熔融状态下与K2O2反应生成K2FeO4,化学方程式是
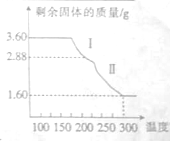
(4)草酸亚铁晶体(FeC2O4?2H2O)是生产锂电池的原材料,某研究性学习小组称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示,300℃时剩余固体只有一种且是铁的氧化物,列式计算该氧化物的化学式:
考点:常见金属元素的单质及其化合物的综合应用,化学方程式的有关计算,难溶电解质的溶解平衡及沉淀转化的本质,电解原理,铁的氧化物和氢氧化物
专题:
分析:(1)高温下铁粉与水蒸气发生置换反应生成四氧化三铁和氢气;
(2)化合物中总化合价为0,可以根据钾离子和氧元素的化合价计算出Fe元素的化合价;
(3)分析反应前后元素化合价变化,根据氧化还原反应中化合价变化相等配平该反应;溶度积越小,在溶液中优先析出,据此进行判断;根据电解原理:阳极发生氧化反应、阴极发生还原反应解答;
(4)3.60g草酸亚铁晶体加热后变成氧化物过程中铁元素的质量不变,可以先计算出3.60g草酸亚铁晶体中Fe元素的质量,然后得出得到的1.60g固体中氧元素的质量,然后计算出铁元素与氧元素的物质的量之比,从而得出该氧化物的化学式.
(2)化合物中总化合价为0,可以根据钾离子和氧元素的化合价计算出Fe元素的化合价;
(3)分析反应前后元素化合价变化,根据氧化还原反应中化合价变化相等配平该反应;溶度积越小,在溶液中优先析出,据此进行判断;根据电解原理:阳极发生氧化反应、阴极发生还原反应解答;
(4)3.60g草酸亚铁晶体加热后变成氧化物过程中铁元素的质量不变,可以先计算出3.60g草酸亚铁晶体中Fe元素的质量,然后得出得到的1.60g固体中氧元素的质量,然后计算出铁元素与氧元素的物质的量之比,从而得出该氧化物的化学式.
解答:
解:(1)高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)
Fe3O4+4H2,
故答案为:水蒸气;
(2)K2FeO4中钾离子的化合价为+1价、氧元素的化合价为-2价,设铁的化合价为x,则x+1×2+(-2)×4=0,解得:x=+6,
故答案为:+6;
(3)Fe2O3在熔融状态下与K2O2反应生成K2FeO4,氧化铁中Fe元素的化合价为+3,中Fe元素的化合价为+6,则化合价变化为3,化合价至少变化为6;K2O2中氧元素的化合价为-1价,化合价至少变化2价,则化合价变化的最小公倍数为6,所以氧化铁的系数为1、K2O2的系数为3,然后根据观察法配平可得:Fe2O3+3K2O2=2K2FeO4+K2O;
在低温下向Na2FeO4溶液中加入饱和KOH溶液可得到K2FeO4,说明K2FeO4的溶解度小于Na2FeO4,所以Ksp(K2FeO4)<Ksp(Na2FeO4);
阳极是铁失电子在碱性溶液中发生氧化反应生成FeO42-,电极反应为:Fe+8OH--6e-=FeO42-+4H2O,所以阳极铁电解逐渐溶解;阴极水电离的氢离子得到电子生成氢气,阴极电极反应为:2H++2e-=H2↑,
故答案为:Fe2O3+3K2O2=2K2FeO4+K2O;<;铁电解逐渐溶解;Fe+8OH--6e-=FeO42-+4H2O;2H++2e-=H2↑;
(4)3.60g草酸亚铁晶体中Fe元素的质量为:3.60g×
=1.12g,300℃时固体质量为1.60g,其中铁元素的质量为1.12g,则氧元素的质量为:1.60g-1.12g=0.48g,则此时得到的氧化物中铁元素与氧元素的物质的量之比为:
:
=2:3,所以该氧化物为氧化铁,化学式为:Fe2O3,
故答案为:Fe2O3.
| ||
故答案为:水蒸气;
(2)K2FeO4中钾离子的化合价为+1价、氧元素的化合价为-2价,设铁的化合价为x,则x+1×2+(-2)×4=0,解得:x=+6,
故答案为:+6;
(3)Fe2O3在熔融状态下与K2O2反应生成K2FeO4,氧化铁中Fe元素的化合价为+3,中Fe元素的化合价为+6,则化合价变化为3,化合价至少变化为6;K2O2中氧元素的化合价为-1价,化合价至少变化2价,则化合价变化的最小公倍数为6,所以氧化铁的系数为1、K2O2的系数为3,然后根据观察法配平可得:Fe2O3+3K2O2=2K2FeO4+K2O;
在低温下向Na2FeO4溶液中加入饱和KOH溶液可得到K2FeO4,说明K2FeO4的溶解度小于Na2FeO4,所以Ksp(K2FeO4)<Ksp(Na2FeO4);
阳极是铁失电子在碱性溶液中发生氧化反应生成FeO42-,电极反应为:Fe+8OH--6e-=FeO42-+4H2O,所以阳极铁电解逐渐溶解;阴极水电离的氢离子得到电子生成氢气,阴极电极反应为:2H++2e-=H2↑,
故答案为:Fe2O3+3K2O2=2K2FeO4+K2O;<;铁电解逐渐溶解;Fe+8OH--6e-=FeO42-+4H2O;2H++2e-=H2↑;
(4)3.60g草酸亚铁晶体中Fe元素的质量为:3.60g×
| 56 |
| 180 |
| 1.12g |
| 56g/mol |
| 0.48g |
| 16g/mol |
故答案为:Fe2O3.
点评:本题考查了金属及其化合物的性质,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,熟练掌握掌握电解原理、氧化还原反应的配平方法为解答关键.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
在同温同压下,下列各组化学反应的反应热△H,前者大于后者的是( )
| A、2H2(g)+O2(g)=2H2O(l) 2H2(g)+O2(g)=2H2O(g) | ||||
B、H2(g)+Cl2(g)=2HCl(g)
| ||||
C、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) NaOH(aq)+
| ||||
D、C(s)+
|
当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A、NaHCO3溶液 |
| B、蔗糖溶液 |
| C、CuSO4溶液 |
| D、Fe(OH)3胶体 |
铝可以制造多种建筑型材.铝在空气中能够稳定存在的原因是( )
| A、铝的活泼性很差 |
| B、铝的还原性很差 |
| C、铝与氧气不反应 |
| D、铝表面有致密的氧化膜 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、c(H+)<c(OH-)的溶液中,Na+、K+、SO42-、ClO- |
| B、能使酚酞变红的溶液中:Na+、Cu2+、CO32-、NO3- |
| C、0.1mol?L-1FeCl3溶液中:K+、NH4-、I-、SCN- |
| D、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- |
 如图所示,已知:
如图所示,已知: