题目内容
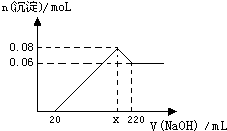 现有MgO和Al2O3的固体混合物,向其中加入100mL 2moL?L-1稀盐酸,充分反应后向溶液中逐滴加入 1moL?L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
现有MgO和Al2O3的固体混合物,向其中加入100mL 2moL?L-1稀盐酸,充分反应后向溶液中逐滴加入 1moL?L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:(1)NaOH溶液加至220mL 时溶液中含有金属元素的离子有
(2)混合物中,MgO与Al2O3的物质的量之比为
(3)根据以上所给数据求出 x=
考点:有关混合物反应的计算
专题:计算题
分析:反应生成氯化铝、氯化镁,盐酸有剩余,向反应后的混合溶液中加入NaOH溶液,恰好使Al3+、Mg2+完全沉淀,此时溶液中溶质为氯化钠,根据钠离子守恒有n(NaOH)=n(HCl),
(1)当NaOH溶液加至220mL 时氢氧化铝恰好完全溶解,所得溶液中含有金属元素的离子是Na+、AlO2-;
(2)沉淀最大量0.08mol到0.06mol的时候消耗氢氧化铝,所以n[Al(OH)3]=0.08-0.06=0.02mol,n[Mg(OH)2]=0.06mol,然后根据守恒求解;
(3)由氢氧化铝的物质的量求消耗的氢氧化钠的体积,即可以得到x的值.
(1)当NaOH溶液加至220mL 时氢氧化铝恰好完全溶解,所得溶液中含有金属元素的离子是Na+、AlO2-;
(2)沉淀最大量0.08mol到0.06mol的时候消耗氢氧化铝,所以n[Al(OH)3]=0.08-0.06=0.02mol,n[Mg(OH)2]=0.06mol,然后根据守恒求解;
(3)由氢氧化铝的物质的量求消耗的氢氧化钠的体积,即可以得到x的值.
解答:
解:(1)当NaOH溶液加至220mL时氢氧化铝恰好完全溶解,所得溶液中含有金属元素的离子是Na+、AlO2-,故答案为:Na+、AlO2-;
(2)沉淀最大量0.08mol到0.06mol的时候消耗氢氧化铝,所以n[Al(OH)3]=0.08-0.06=0.02mol,n[Mg(OH)2]=0.06mol,根据铝守恒得Al2O3的物质的量0.01mol,MgO的物质的量0.06mol,所以MgO与Al2O3的物质的量之比为6:1,故答案为:6:1;
(3)溶解0.02mol氢氧化铝需要氢氧化钠0.02mol,体积为:
=20ml,所以x=220-20=200ml,故答案为:200.
(2)沉淀最大量0.08mol到0.06mol的时候消耗氢氧化铝,所以n[Al(OH)3]=0.08-0.06=0.02mol,n[Mg(OH)2]=0.06mol,根据铝守恒得Al2O3的物质的量0.01mol,MgO的物质的量0.06mol,所以MgO与Al2O3的物质的量之比为6:1,故答案为:6:1;
(3)溶解0.02mol氢氧化铝需要氢氧化钠0.02mol,体积为:
| 0.02mol |
| 1moL?L-1 |
点评:本题考查了混合物的计算,明确最后溶液中的溶质是解本题关键,本题采取守恒法解答,如果考虑每一步反应较麻烦且易出现错误,同时考查学生分析问题及解决问题的能力,题目难度中等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
下列关于物质的量的叙述中,正确的是( )
| A、1mol食盐含有6.02×1023个分子 |
| B、Mg的摩尔质量为24 |
| C、1mol水中含有2mol氢和1mol氧 |
| D、1molNe含有6.02×1024个电子 |
下列说法中正确的是( )
| A、1 L 水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L |
| C、配制500 mL 0.2 mol/L的CuSO4溶液,需称量CuSO4固体的质量为16.0g |
| D、中和100 mL 1 mol/L的H2SO4溶液,需NaOH的质量为4.0g |
甲乙两个装置中,胶头滴管中吸入某种液体,广口瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大(忽略液体体积对气球的影响).则所用试剂可能是( )

| A、甲:NaOH溶液和CO2,乙:H2O2和MnO2 |
| B、甲:CaCl2和Na2CO3溶液,乙:NaOH溶液和Cl2 |
| C、甲:浓硫酸和铝片.乙:浓氨水和SO2 |
| D、甲:浓硫酸和蔗糖.乙:水和氯化氢气体 |
 反应mX(g)?nY(g)+pZ(g)△H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示.下列说法错误的是( )
反应mX(g)?nY(g)+pZ(g)△H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示.下列说法错误的是( )| A、该反应的△H>O |
| B、m<n+p |
| C、B、C两点化学平衡常数:KB>KC |
| D、A、C两点的反应速率v(A)<v(C) |