题目内容
10.下列反应过程能量变化如下所示:H2(g)+Cl2(g)═2HCl(g)△H
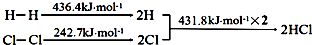
下列说法错误的是( )
| A. | H-H键比Cl-Cl键稳定 | |
| B. | △H=-184.5 kJ•mol-1 | |
| C. | 正反应活化能比逆反应活化能高 | |
| D. | 在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时△H相同 |
分析 A.键能越大,化学键越稳定;
B.△H=反应物键能总和-生成物键能总和;
C.H2(g)+Cl2(g)═2HCl(g)△H<0,说明正反应活化能比逆反应活化能低;
D.反应热与反应的条件无关.
解答 解:A.因为H2的键能大于Cl2的键能,所以H-H键比Cl-Cl键稳定,故A正确;
B.△H=(436.4 kJ•mol-1+242.7 kJ•mol-1)-(431.8 kJ•mol-1)×2=-184.5 kJ•mol-1,故B正确;
C.H2(g)+Cl2(g)═2HCl(g)△H<0,说明正反应活化能比逆反应活化能低,故C错误;
D.△H与起点和终点有关,与反应的条件无关,故D正确;
故选C.
点评 本题考查了反应热的计算,难度不大,△H=反应物键能总和-生成物键能总和是计算反应热的常用公式.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
20.下列有关化学用语的表示正确的是( )
| A. | 中子数为18的氯原子:${\;}_{17}^{35}Cl$ | B. | 二氧化碳分子的比例模型: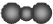 | ||
| C. | HClO的电子式: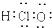 | D. | 甲烷分子的球棍模型: |
1.锂原子比镁原子少1个电子层,最外层电子数也比镁原子少1,在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性.下列关于锂的判断可能正确的是( )
| A. | Li能在空气中燃烧 | B. | Li2O只有共价键 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受热不分解 |
5.反应N2(g)+3H2(g)?2NH3(g)△H<0;若升温,则反应速率v(正)、v(逆)的变化是( )
| A. | 同时减少 | B. | 同时增大 | C. | v(正)增大,v(逆)减少 | D. | v(正)减少,v(逆)增大 |
15.下列四种NaHCO3溶液分别加入到四个盛有10mL 2mol•L-1盐酸的烧杯中,均加水稀释到50mL,则反应最快的是( )
| A. | 10℃20mL 3 mol•L-1的NaHCO3溶液 | B. | 20℃30mL 2 mol•L-1的NaHCO3溶液 | ||
| C. | 20℃10mL 4 mol•L-1的NaHCO3溶液 | D. | 10℃10mL 2 mol•L-1的NaHCO3溶液 |
2.化学与生产、生活密切相关.下列叙述中,不正确的是( )
| A. | 在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 | |
| B. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理不同 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
19.W、X、Y、Z为原子序数依次增加的短周期主族元素,它们的电子层数之和为9,它们的族序数之和为19,其中X的最高价氧化物对应的水化物能与W、X形成的简单化合物化合生成盐M.下列说法正确的是( )
| A. | 单质的沸点:Y<X | B. | 简单离子半径:Y<Z | ||
| C. | 盐M的水溶液显酸性 | D. | 最高化合价:X>Y>Z |
20.有一铁粉和氧化铜的混合物8.32g,进行如图实验.

根据实验所得数据,有关说法正确的是( )

根据实验所得数据,有关说法正确的是( )
| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
 ;
;