题目内容
3.一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b.的代数式表示该混合溶液中醋酸的电离常数为:$\frac{2b×1{0}^{-7}}{a-2b}$.分析 通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$.
解答 解:通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{b×1{0}^{-7}}{\frac{a}{2}-b}$=$\frac{2b×1{0}^{-7}}{a-2b}$,
故答案为:$\frac{2b×1{0}^{-7}}{a-2b}$.
点评 本题考查电离平衡常数的有关计算、弱电解质的电离等知识点,侧重考查学生分析计算能力,注意电离平衡常数的表达式的书写.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
13.诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为( )
| A. | 3:3:2 | B. | 2:2:3 | C. | 3:28:27 | D. | 1:1:1 |
14.过程的自发性的作用是( )
| A. | 确定过程是否一定会发生 | B. | 判断过程的方向 | ||
| C. | 判断过程发生的速率 | D. | 判断过程的热效应和熵变 |
11.向0.lmol/L NaOH溶液中通入过量的CO2后,溶液中存在的主要离子是( )
| A. | Na+、CO32- | B. | Na+、HCO3- | C. | CO32-、HCO3- | D. | Na+、OH- |
8.下列有关非金属元素说法正确的是( )
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 硫具有还原性,可用硫粉覆盖地上洒落的汞 | |
| D. | 硅是重要的半导体材料,常用于制作光导纤维 |
12.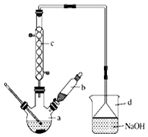 溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.再将b中的液溴慢慢加入a中,充分反应.装置a中主要反应:2Fe+3Br2═2FeBr3,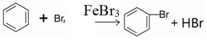 ;装置d的作用吸收HBr和溴蒸气;防止倒吸.
;装置d的作用吸收HBr和溴蒸气;防止倒吸.
(2)反应过程中,a外壁温度升高.为提高原料的利用率,可采取以下措施:
①采用装置c进行冷凝回流,回流的主要物质有C6H6、Br2.
②利用温度计控制温度,适宜的温度范围为C(填序号).
A.>156℃B.59℃-80℃C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
步骤②中NaOH溶液洗涤的主要作用是(用化学方程式表示)Br2+2NaOH=NaBr+NaBrO+H2O;
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填序号).
A.分液 B.过滤 C.蒸馏 D.萃取
(5)在该实验中,a的容积最适合的是B(填序号).
A.25mL B.50mL C.250mL D.500mL.
 溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.再将b中的液溴慢慢加入a中,充分反应.装置a中主要反应:2Fe+3Br2═2FeBr3,
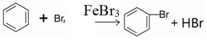 ;装置d的作用吸收HBr和溴蒸气;防止倒吸.
;装置d的作用吸收HBr和溴蒸气;防止倒吸.(2)反应过程中,a外壁温度升高.为提高原料的利用率,可采取以下措施:
①采用装置c进行冷凝回流,回流的主要物质有C6H6、Br2.
②利用温度计控制温度,适宜的温度范围为C(填序号).
A.>156℃B.59℃-80℃C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
步骤②中NaOH溶液洗涤的主要作用是(用化学方程式表示)Br2+2NaOH=NaBr+NaBrO+H2O;
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填序号).
A.分液 B.过滤 C.蒸馏 D.萃取
(5)在该实验中,a的容积最适合的是B(填序号).
A.25mL B.50mL C.250mL D.500mL.
9.下列有关材料的叙述中,不正确的是( )
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐材料 | |
| B. | 用于制作灯饰外壳材料的聚苯乙烯塑料属于有机高分子材料 | |
| C. | 氮化硅结构陶瓷可以用来做发动机的部件 | |
| D. | 高吸水性材料、光敏性材料等属于功能高分子材料 |
