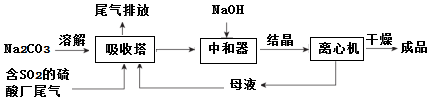
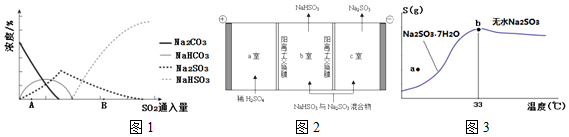
题目内容
20.硫酸氢钠溶于水的过程中( )| A. | 只破坏离子键 | |
| B. | 既破坏离子键,也破坏共价键 | |
| C. | 只破坏共价键 | |
| D. | 既破坏离子键,也破坏分子间作用力 |
分析 硫酸氢钠溶于水的过程中,发生了电离:NaHSO4=Na++H++SO42-,据此分析.
解答 解:硫酸氢钠溶于水的过程中,发生了电离:NaHSO4=Na++H++SO42-,既破坏离子键,也破坏共价键,故B正确;
故选B.
点评 本题考查了化学键的判断,难度不大,注意硫酸氢钠在水中电离和熔融状态下电离的区别,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
10.下列解释事实的化学方程式或离子方程式不正确的是( )
| A. | 在燃煤时加入适量石灰石,可减少 SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 | |
| B. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶液的 PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 | |
| C. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2 +2H2O | |
| D. | 在盐碱地(含较多 NaCl、Na2CO3)上通过施加适量 CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4 |
11.下列离子方程式中正确的是( )
| A. | Na2O2溶于水:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 向氧化铁中加入氢碘酸发生反应:Fe2O3+6HI═2Fe2++I2+3H2O+4I- | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 漂白粉溶液中通入过量的CO2:ClO-+CO2+H2O═HClO+HCO3- |
8.下列关于镁和钠的比较,结论正确的是( )
| A. | 铝镁合金的硬度较大,钠钾合金的硬度较小 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜溶液中的铜,钠也能置换硫酸铜溶液中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,氧在产物中的化合价都是-2 |
5.如图是自然界中N、S两种元素的循环过程:根据图内容,判断下列说法正确的是( )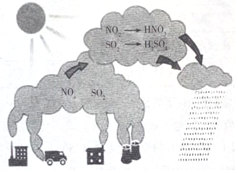

| A. | 图示过程表示了地球臭氧层的破坏过程 | |
| B. | 图中涉及的氧化物均为酸性氧化物 | |
| C. | 机动车尾气含有N的氧化产物 | |
| D. | 图示中描述的过程所涉及的反应均为氧化还原反应 |
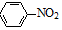 +4Mg+8CH3OH→
+4Mg+8CH3OH→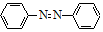 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
 太原市自2016年11月1日零时起,将汽车用油全部更换为”国V标准”车用燃料,进而 改善太原市空气质量.下列物质中,不会造成空气污染的是( )
太原市自2016年11月1日零时起,将汽车用油全部更换为”国V标准”车用燃料,进而 改善太原市空气质量.下列物质中,不会造成空气污染的是( )