题目内容
9.低浓度SO2废气的处理是工业难题,工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如图.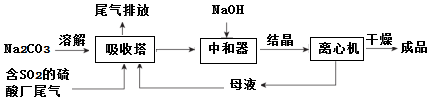
(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合理措施控制SO2流速、增大Na2CO3溶液的浓度.(写出两条)
(2)中和器中发生的主要反应的离子方程式是HSO3-+OH-=SO32-+H2O.
(3)图1为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.
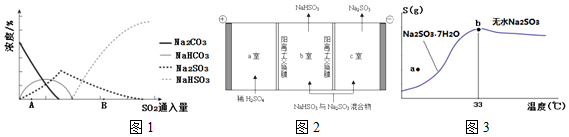
①则初期反应(图中A点以前)的化学方程式是2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3.
②通过电解法可分离图中B点NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如图2:简述分离NaHSO3与Na2SO3混合物的原理阳极4OH--4e-=2H2O+O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3;阴极2H+-2e-=H2↑,导致HSO3-H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3.
(4)图3是亚硫酸钠的溶解度曲线(温度在33℃前后对应不同物质),下列说法正确的是B
A.a点时溶液为不饱和溶液
B.b点时Na2SO3•7H2O和无水Na2SO3共存
C.制备无水Na2SO3,应该在95~100℃加热浓缩,冷却至室温结晶
(5)如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是C
A.Na2SO3 B.Na2S C.Ba(NO3)2 D.酸性KMnO4.
分析 利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,吸收塔中发生的反应为2CO32-+SO2+H2O=2HCO3-+SO32-,为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的,加入氢氧化钠进入中和器得到溶液结晶进入离心机干燥得到晶体,滤液重新进入吸收塔循环使用,
(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合理措施有控制SO2流速、增大Na2CO3溶液的浓度、适当升温、采用气液逆流法、喷淋法或将Na2CO3溶液雾化等;
(2)随着二氧化硫通入量增大,后期生成主要是得到亚硫酸氢钠,中和器中主要是将亚硫酸氢钠转化为硫酸钠,同时碳酸氢钠反应得到碳酸钠;
(3)①由图可知,初期反应(图中A点以前)碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠;
②电解法可分离NaHSO3与Na2SO3混合物,阳极发生氧化反应,失去电子生成氧气,氢离子和亚硫酸根离子反应生成亚硫酸氢根离子,阴极发生还原反应生成氢气,导致HSO3-?H++SO32-正向移动,NaHSO3转化为Na2SO3;
(4)分析曲线,处于曲线上的点为饱和溶液状态,根据不同温度所得晶体不同分析;
(5)依据选项中的溶液性质和二氧化硫反应的过程和化学方程式定量关系分析计算.
解答 解:(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合理措施有:控制SO2流速、增大Na2CO3溶液的浓度、适当升温、采用气液逆流法、喷淋法或将Na2CO3溶液雾化等;
故答案为:控制SO2流速、增大Na2CO3溶液的浓度(适当升温、采用气液逆流法、喷淋法或将Na2CO3溶液雾化等);
(2)随着二氧化硫通入量增大,后期生成主要是得到亚硫酸氢钠,中和器中主要是将亚硫酸氢钠转化为硫酸钠,同时碳酸氢钠反应得到碳酸钠,发生的离子方程式为:HSO3-+OH-=SO32-+H2O;
故答案为:HSO3-+OH-=SO32-+H2O;
(3)①由图可知,初期反应(图中A点以前)碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠,反应反应方程式为:2Na2CO3+SO2+H2O=2 NaHCO3+Na2SO3;
故答案为:2Na2CO3+SO2+H2O=2 NaHCO3+Na2SO3;
②通过电解法可分离NaHSO3与Na2SO3混合物,阳极2H2O-4e-=4H++O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3.阴极2H+-2e-=H2↑,导致HSO3-?H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3,实现Na2SO3的循环利用;
故答案为:阳极4OH--4e-=2H2O+O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3;阴极2H+-2e-=H2↑,导致HSO3- H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3;
(4)A.处于曲线上的点为饱和溶液状态,A点在曲线上方,应为过饱和溶液,故A错误;
B.B点为生成晶体的转折点,两种晶体可以共存,故B正确;
C.由于冷却至33℃以下时析出Na2SO3•7H2O,应在维持95~100℃蒸发浓缩至有大量晶体析出,再利用余热蒸干,故C错误;
故答案为:B;
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,
A.Na2SO3 吸收二氧化硫发生的反应为:Na2SO3+SO2+H2O=2NaHSO3,1molNa2SO3 最多吸收二氧化硫1mol;
B.Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;
C.Ba(NO3)2 吸收二氧化硫反应化学方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2H2SO4+2NO↑:1molBa(NO3)2最多吸收二氧化硫3mol;
D.酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5mol;
吸收量最多的是Ba(NO3)2;
故答案为:C.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、信息获取与迁移运用等,需要学生具备扎实的基础.

| A. | 酸雨有很大的危害,应提倡工厂使用清洁能源,减少CO2的排放 | |
| B. | 木材浸过水玻璃后,具有良好的防火性能 | |
| C. | 烧碱和纯碱都属于碱 | |
| D. | 氯气泄漏后,人应逆风且往低处跑 |
| A. | 只破坏离子键 | |
| B. | 既破坏离子键,也破坏共价键 | |
| C. | 只破坏共价键 | |
| D. | 既破坏离子键,也破坏分子间作用力 |

(1)①中反应的离子方程式是3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+.
(2)②中逸出的无色气体是CO2.从物质类别的角度分析,Na2CO3与Na2SO3在化学性质方面的共性是两者都为强碱弱酸盐,能与强酸反应(写一条);从化合价的角度分析,Na2CO3与Na2SO3在化学性质方面的差异是Na2CO3中碳原子为最高正价+4,无还原性;Na2SO3中硫原子+4价,具有较强的还原性(写一条).
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀.甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的.其实验方案是取③中的红棕色溶液少许,滴加铁氰化钾溶液,出现蓝色沉淀.
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
| 实验操作及现象 | ④向2mL 0.2mol/L FeCl3溶液中滴入2mL1mol/L NaF溶液,溶液变无色. |
| ⑤向2mL 0.2mol/L FeCl3溶液中滴入2mL 蒸馏水,溶液颜色变浅. |
Ⅱ.为探究④中溶液变无色的原因,进行如图2实验:(资料显示:FeF3溶液为无色.)用平衡移动原理解释红褐色沉淀产生的原因无色溶液中存在平衡:Fe3++3F-?FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与碱性物质的pH、离子的性质有关.
 2NH3,该反应中的氧化剂是N2.
2NH3,该反应中的氧化剂是N2.