题目内容
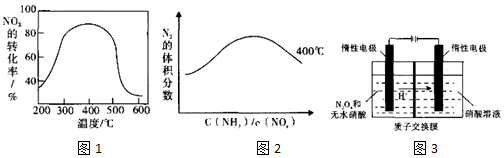
12.[Cu(NH3)4]SO4•H2O是一种重要的染料及合成农药中间体,受热可分解.某化学课外小组设计了如图1实验(部分夹持装置略)验证它的部分分解产物,请回答问题: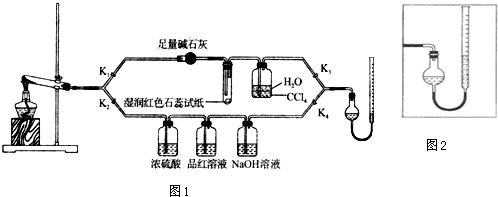
(1)连接装置,检查装置气密性,在各装置中加入相应的药品和试剂.
(2)打开K2、K4,闭合K1、K3,加热一段时间后观察到品红溶液褪色,写出NaOH溶液中发生反应的离子方程式SO2+2OH-=SO32-+H2O.
(3)打开K1、K3,闭合K2、K4,继续加热一段时间后观察到湿润红色石蕊试纸变蓝,证明分解产物中含有NH3(填化学式).
(4)CCl4的作用是防止倒吸.
(5)加热过程中,还生成Cu、N2和H2O.写出[Cu(NH3)4]SO4•H2O分解的化学方程式3[Cu(NH3)4]SO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+8NH3↑+2N2↑+3SO2↑+9H2O
(6)若实验中称取a g[Cu(NH3)4]SO4•H2O,收集到b mL N2(已换算成标准状况),[Cu(NH3)4]SO4•H2O的分解率表达式为$\frac{3×246×b×10{\;}^{-3}}{2×22.4×a}$×100%.
(7)量气管读数时需注意的事项有:①气体冷却到室温;②量气装置两侧液面相平;③视线与凹液面最低处相平.若某同学按图2所示读数,则计算出的分解率偏低(填“偏高”“偏低”或“无影响”).
分析 (1)加热中有气体生成,由装置图可知,还进行气体体积的测定,加入药品前需要检验装置气密性;
(2)观察到品红溶液褪色,说明分解生成二氧化硫,氢氧化钠溶液吸收二氧化硫生成亚硫酸钠,便于后续气体体积测定;
(3)观察到湿润红色石蕊试纸变蓝,说明分解生成氨气;
(4)用水吸收生成氨气,以便于后续气体体积的测定,而氨气极易溶于水,直接用水吸收会发生倒吸;
(5)加热过程中,还生成Cu、N2和H2O,由上述分析可知有氨气、二氧化硫生成;
(6)根据氮气的体积,结合方程式计算分解的[Cu(NH3)4]SO4•H2O的质量,进而计算其分解率;
(7)读数还需要视线与凹液面最低处相平;若某同学按图2所示读数,气体的压强大于大气压,气体被压缩,测定气体的体积偏小.
解答 解:(1)加热中有气体生成,由装置图可知,还进行气体体积的测定,加入药品前需要检验装置气密性,
故答案为:检查装置气密性;
(2)观察到品红溶液褪色,说明分解生成二氧化硫,氢氧化钠溶液吸收二氧化硫生成亚硫酸钠,便于后续气体体积测定,反应离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O;
(3)观察到湿润红色石蕊试纸变蓝,说明分解生成氨气,
故答案为:NH3;
(4)用水吸收生成氨气,以便于后续气体体积的测定,而氨气极易溶于水,直接用水吸收会发生倒吸,导管伸入四氯化碳中,氨气不被四氯化碳吸收,可以防止倒吸,
故答案为:防止倒吸;
(5)加热过程中,还生成Cu、N2和H2O,由上述分析可知有氨气、二氧化硫生成,[Cu(NH3)4]SO4•H2分解的化学方程式为:3[Cu(NH3)4]SO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+8NH3↑+2N2↑+3SO2↑+9H2O,
故答案为:3[Cu(NH3)4]SO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+8NH3↑+2N2↑+3SO2↑+9H2O;
(6)设分解的[Cu(NH3)4]SO4•H2O的质量为m,则:
3[Cu(NH3)4]SO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+8NH3↑+2N2↑+3SO2↑+9H2O
3×246g 2×22.4L
m b×10-3L
所以m=$\frac{3×246g×b×10{\;}^{-3}L}{2×22.4L}$=$\frac{3×246×b×10{\;}^{-3}}{2×22.4}$g
[Cu(NH3)4]SO4•H2O的分解率表达式为$\frac{\frac{3×246×b×10{\;}^{-3}}{2×22.4}}{a}$×100%=$\frac{3×246×b×10{\;}^{-3}}{2×22.4×a}$×100%,
故答案为:$\frac{3×246×b×10{\;}^{-3}}{2×22.4×a}$×100%;
(7)读数还需要视线与凹液面最低处相平;
若某同学按图2所示读数,气体的压强大于大气压,气体被压缩,测定气体的体积偏小,计算分解的[Cu(NH3)4]SO4•H2O的质量偏小,故[Cu(NH3)4]SO4•H2O的分解率偏低,
故答案为:视线与凹液面最低处相平;偏低.
点评 本题考查验证型实验方案、分解率有关计算、元素化合物性质、对原理与装置的分析评价、误差分析、化学实验基本操作等,是对化学实验的综合考查,关键是理解各装置作用,较好的考查学生实验能力、分析解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | Na2CO3和H2SO4 | B. | AlC13和NaOH | C. | NaAlO2和H2SO4 | D. | NaHCO3和Ba(OH)2 |
| A. | 向次氯酸钙溶液通过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+CO32-+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+=3I2+3H2O | |
| D. | 氢氧化钡溶液中加入硫酸:Ba2++OH-+H++SO42-═BaSO4+H2O |
| A. | Fe3+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、I-、NO3- | ||
| C. | Fe2+、Cu2+、AlO2-、ClO- | D. | Na+、Ca2+、Cl-、CO32- |
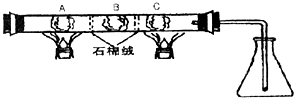 在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
 .
. .
.
 .
.