题目内容
13.氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.(1)化合物甲(由氮和另一种常见的主族元素组成)是一种新型无机材料.将8.2g甲溶于足量的氢氧化钠溶液,可产生标准状况下为4.48L的气体,该气体可作制冷剂.向反应后的溶滚中逐滴加入稀盐酸,产生白色沉淀质量最大为15.6g,继续滴加沉淀消失.则甲溶于氢氧化钠的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑.
(2)NH3催化还原氮氧化物是目前应用广泛的烟气氮氧化物脱除技术.例如:
4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H1
己知:①H2O(l)=H2O(g)△H2
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3
则NH3(g)的标准燃烧热△H=$\frac{3△{H}_{3}+2△{H}_{1}-30△{H}_{2}}{20}$.
以FeSO4作催化剂在不同温度下,经过相同的时间测试氨还原氮氧化物效果如图1,当反应在400~450℃,NOx的转化率随温度升高而降低.当体系温度升至500℃以上时.NOx的转化率迅速下降,其可能原因是催化剂活性降低(FeSO4受热分解).图2反映的是在400℃N2的体积分数与反应物中$\frac{c(N{H}_{3})}{c(N{O}_{x})}$的关系,请在下面的图2上画出450℃的变化趋势曲线.

(3)N2O5是绿色硝化试剂,溶于水可得硝酸.图3是以N2O4为原料电解制备N2O5的装置示意图.写出阳极区生成N2O5的电极反应式是N2O4-2e-+2HNO3=2N2O5+2H+.
(4)常温下,向0.1mol/L氨水中加入少许N2O5,使溶液中c(NH3•H2O):c(NH4+)=5:9,此时溶液的pH=9.(25℃时.NH3•H2O的电离平衡常数Kb=1.8×10-5)
分析 (1)化合物甲(由氮和另一种常见的主族元素组成),溶于足量的氢氧化钠溶液,产生的气体可作制冷剂为氨气,反应后的溶滚中逐滴加入稀盐酸,先沉淀后沉淀为溶解,为铝的化合物的特征,结合相关数据推出化合物甲为氮化铝;
(2)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物,根据盖斯定律来计算NH3(g)的标准燃烧热△H;NOx的转化率随温度升高而降低,可能为催化剂活性降低;催化剂可以加快反应速率;根据纵坐标判断,相同温度下,脱除率越高的效果越好,脱氮反应是氨气和二氧化氮、一氧化氮发生氧化还原反应生成氮气和水;当反应在400~450℃,NOx的转化率随温度升高而降低,图2上画450℃的变化趋势曲线,注意450℃氮气的体积分数小于400℃;
(3)NO2可电解制备绿色硝化试剂N2O5.N元素化合价升高,NO2被氧化,为电解池阳极反应;
(4)常温下,向0.1mol/L氨水中加入少许N2O5,五氧化二氮和水反应生成硝酸,硝酸和氨水反应,溶液中c(NH3•H2O):c(NH4+)=5:9,溶液中溶质为硝酸铵和一水合氨,根据NH3•H2O的电离平衡常数计算.
解答 解:(1)化合物甲(由氮和另一种常见的主族元素组成),溶于足量的氢氧化钠溶液,产生的气体可作制冷剂为氨气,产生标准状况下为4.48L的气体,n(NH3)=$\frac{4.48L}{22.4L/mol}$=0.2mol,反应后的溶滚中逐滴加入稀盐酸,先沉淀后沉淀为溶解,为铝的化合物的特征,产生白色沉淀质量最大为15.6g,为氢氧化铝,n[Al(OH)3]=$\frac{15.6g}{78g/mol}$=0.2mol,则m(N)+m(Al)=0.2mol×14g/mol+0.2mol×27g/mol=8.2g,则8.2g甲为AlN,甲溶于氢氧化钠的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(2)氨气燃烧生成氮气和水,①4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H1②H2O(l)=H2O(g)△H2 ③4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3根据盖斯定律,将已知热化学方程式$\frac{1}{20}$(③×3+①×2-②×30)得:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=$\frac{3△{H}_{3}+2△{H}_{1}-30△{H}_{2}}{20}$;当反应在400~450℃,NOx的转化率随温度升高而降低.当体系温度升至500℃以上时,催化剂硫酸亚铁受热分解,催化剂活性降低,所以450℃的变化趋势曲线图为: ,
,
故答案为:$\frac{3△{H}_{3}+2△{H}_{1}-30△{H}_{2}}{20}$;催化剂活性降低(FeSO4受热分解); ;
;
(3)NO2可电解制备绿色硝化试剂N2O5.N元素化合价升高,NO2被氧化,电极方程式为N2O4-2e-+2HNO3=2N2O5+2H+,
故答案为:N2O4-2e-+2HNO3=2N2O5+2H+;
(4)常温下,向0.1mol/L氨水中加入少许N2O5,五氧化二氮和水反应生成硝酸,硝酸和氨水反应,溶液中c(NH3•H2O):c(NH4+)=5:9,溶液中溶质为硝酸铵和一水合氨,NH3•H2O?NH4++OH-,25℃时.NH3•H2O的电离平衡常数Kb=1.8×10-5=$\frac{C(O{H}^{-})×\frac{9}{14}×0.1}{\frac{5}{14}×0.1}$,c(OH-)=10-5mol/L,c(H+)=10-9mol/L,PH=9,
故答案为:9.
点评 本题综合考查含氮化合物知识,为高频考点,侧重考查学生的分析、计算能力,题目涉及化学方程式书写以及电解知识、弱电解质的电离,注意把握盖斯定律以及电解原理的应用,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) | |
| B. | 0.1 mol/L的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| C. | 0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) | |
| D. | 10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| A. | 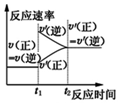 对于达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 | |
| B. | 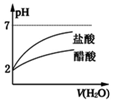 将pH=2的盐酸和醋酸分别加水稀释 | |
| C. | 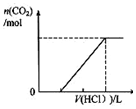 表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 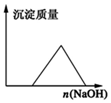 在AlCl3溶液中滴入NaOH溶液至过量 |
| A. | 氯碱工业中电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 氢氧化钠溶液吸收少量二氧化硫SO2+OH-=HSO3- | |
| D. | 稀硫酸中加氢氧化钡溶液至中性:Ba2++H++OH-+SO42-=BaSO4↓+H2O |
| A. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,不需要干燥 | |
| B. | 在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器 | |
| C. | 在测量或监测温度时,温度计水银球不能碰到容器内璧或底部 | |
| D. | 分液漏斗使用前需要检漏,确认不漏水后方可使用 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑪ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)地壳中含量最多的金属元素是Al.写出元素⑥的最简单氢化物的化学式CH4.
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)写出③、④、⑤对应离子氧化性由强到弱的是Al3+>Mg2+>Na+,②、⑦、⑩对应氢化物酸性由强到弱的是HBr>HCl>HF.
(5)写出⑤与氢氧化钠溶液反应的化学方程式:2Al+2NaOH+2H2O═2NaAlO2+3H2↑..

